无机声敏剂在肿瘤治疗和诊断中的研究进展
时间:
论文《无机声敏剂在肿瘤治疗和诊断中的研究进展》发表在《分析化学》,版权归《分析化学》所有。本文来自网络平台,仅供参考。
摘要
声动力治疗是一种以超声刺激声敏剂产生活性氧进而诱导癌细胞死亡的癌症治疗新方法。相较于有机声敏剂,无机声敏剂在稳定性、毒性、水溶性、肿瘤靶向性和功能调控等方面更具优势,在肿瘤的治疗和诊断方面显示出广阔的应用前景。得益于无机声敏剂优异的性质,目前研究者开发出众多基于无机纳米材料的声敏剂,主要包括钛基声敏剂、其它金属基声敏剂和非金属基声敏剂,并探索了其在肿瘤诊疗方面的应用。本文介绍了无机声敏剂的作用机理,即声动力治疗机理,概述了不同体系的无机声敏剂在肿瘤治疗和诊断中的研究进展,总结了提高声动力治疗效果的方法,并对目前无机声敏剂存在的问题和未来的发展前景进行了总结和展望。
Abstract
Sonodynamic therapy (SDT) is an emerging approach of cancer treatment that stimulates sonosensitizers by ultrasound to produce reactive oxygen species (ROS) and induce cancer cell death. Compared with organic sonosensitizers, inorganic sonosensitizers have many advantages in stability, toxicity, water solubility, tumor targeting and functional regulation, showing extensive potentials in diagnosis and treatment of tumors. Thanks to the excellent properties, numerous sonosensitizers based on inorganic nanomaterials have been reported, mainly including titanium-based sonosensitizers, other metal-based sonosensitizers and non-metal-based sonosensitizers, and their prospects in diagnosis and treatment of tumor have been discussed. This review introduced the mechanism of SDT, overviewed the research progress of different systems of inorganic sonosensitizers in treatment and diagnosis of tumor, and summarized the methods to improve the therapeutic effect of SDT. Finally, the existing problems and development perspective of inorganic sonosensitizers were discussed and prospected.
Keywords
Inorganic sonosensitizers; Sonodynamic therapy; Imaging diagnosis; Review
引言
恶性肿瘤是威胁人类生命健康的第一杀手,开发高效的恶性肿瘤治疗手段至关重要。传统的治疗手段主要包括手术、化疗和放疗,均存在一些弊端,如侵入性治疗、创面大、毒副作用大和恢复慢等,还存在引发第二原发癌的风险[1-3]。纳米科学的进步以及纳米技术与生物医学工程的交叉融合为肿瘤精准诊疗带来了新机遇,各种新兴的肿瘤治疗方法不断涌现。相较于手术对人体造成的重大创伤,以及放疗和化疗对正常组织也同时造成大范围损伤的治疗方式,非侵入性光疗法以外源性的光为刺激源,实现对病灶部位的定点治疗,极大地减少了对正常组织的损伤。然而,光疗法严重依赖于光的组织穿透性,对于深部肿瘤通常不能达到良好的治疗效果,具有一定的局限性。声动力治疗(SDT)以超声波(Ultrasound, US)为外部刺激源,其组织穿透深度比光疗法更深,并且可以通过调节超声的频率和强度精确聚焦到肿瘤部位,最大限度减少对正常组织的损伤,具有传统治疗方法和光疗法不可比拟的优势。
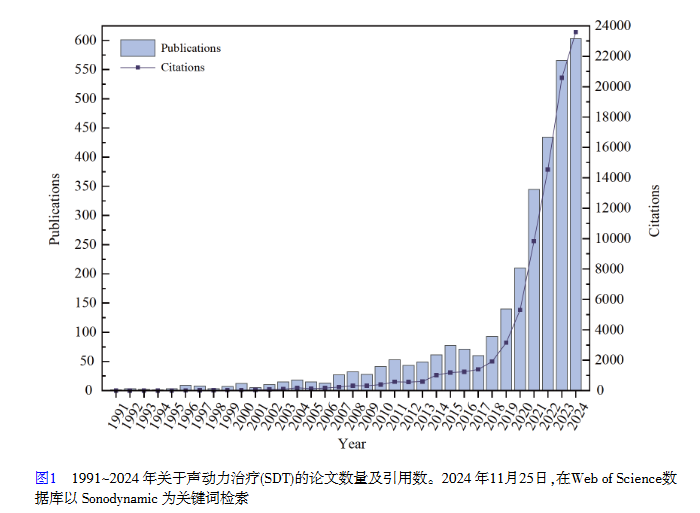
SDT是与光疗法类似的非侵入性治疗方法,其不同点在于SDT以超声为刺激,激活声敏剂在肿瘤部位产生具有细胞毒性的活性氧(ROS)进而诱导癌细胞死亡。1989年,Yumita等[4]研究发现血卟啉与超声协同作用可以有效杀死肿瘤细胞,揭开了SDT的研究序幕。1991年召开的超声波研讨会首次提出了SDT的概念。在之后的三十多年,SDT进入了蓬勃发展的时期(图1),各种超声响应的有机物与无机物相继被报道。
超声响应的有机物包括最早发现的卟啉类物质[4-6]、5-氨基乙酰丙酸[7]、酞菁[8-9]、一些天然产物[10-11]和喹诺酮类抗生素[12-13]等。有机声敏剂存在光毒性、不稳定性、水溶性差或肿瘤靶向性差等问题[14];相比之下,无机声敏剂的尺寸与形态可控、易于修饰、物理与化学性质优异,并且具有高肿瘤靶向性,在肿瘤诊疗领域显示出独特的优势。
本文概述了近年来无机声敏剂在肿瘤治疗和诊断中的研究进展。首先介绍了声动力治疗的基本原理,讨论了影响声动力治疗效果的因素,并总结了提升SDT效果的策略;其次,归纳了不同体系无机声敏剂的研究进展和抗肿瘤机制,并概述了无机声敏剂在肿瘤成像方面的研究进展和应用原理;最后,针对无机声敏剂存在的问题及未来发展方向进行了总结和展望。
1 声动力治疗的机理及其一般原则
超声波是一种波长极短的机械波,被广泛应用于医学诊断和治疗。相较于光波,超声波具有更好的组织穿透性(紫外或可见光:<1 cm;近红外光:<10 cm;超声波:>10 cm[15-17])。近年来,以超声波敏化声敏剂产生ROS来杀死癌细胞的SDT被广泛研究[18]。1989年,Yumita等[4]研究了血卟啉、超声以及二者共存时对肿瘤细胞的影响,证明血卟啉增加了肿瘤细胞对超声的敏感性。该研究表明只有低功率的超声波存在时不足以损坏大部分肿瘤细胞,而声敏剂与超声波同时作用时的治疗效果远超对照组,这与SDT的机制有关。如图2A所示,SDT的可能机制包括超声诱导的细胞死亡、超声空化和声化学效应[19]。首先,超声可以直接诱导细胞死亡[20];其次,超声空化和声化学效应相结合可以产生ROS以杀死肿瘤细胞。SDT过程中产生ROS的机制如图2B和2C所示。对于无机声敏剂,电子从基态转移到激发态有两种方式:一是声敏剂直接被超声活化激发;二是超声波在溶液中传播使空化气泡形成及崩溃,即超声空化现象。空化过程中伴随有声致发光,电子也可被声致发光激发至激发态而形成负电子,留下正空穴。负电子可以还原氧气而产生超氧自由基阴离子,正空穴可以氧化水和氢氧根离子生成羟基自由基和过氧化氢分子。此外,电子和空穴可以复合形成激子,伴随有光子的发射,进而激发基态氧形成单线态氧[21]。通过以上过程生成具有高细胞毒性的ROS,能够诱导DNA片段化、细胞骨架收缩和染色质收缩,从而导致细胞死亡[19,22]。此外,空化气泡的破裂在原位产生热量和强烈的剪切力,对细胞骨架和细胞膜造成严重的热和机械损伤,从而引发肿瘤细胞死亡。
基于SDT的治疗机制,可以通过以下两种方法增强SDT的治疗效果。(1)通过调节声敏剂的带隙结构,促进电子-空穴对的分离速率,捕获光激发电子,防止电子-空穴对复合,提高ROS的产生水平。Cao等[23]在TiO₂边缘选择性生长Au得到Au-TiO₂。在超声照射下,Au-TiO₂的ROS生成效率比纯TiO₂高,这是因为负载的Au阻止受激的电子-空穴快速复合。(2)可以通过调节肿瘤微环境(TME)增强SDT的治疗效果。TME具有乏氧、弱酸性、谷胱甘肽(GSH)过表达等特征,SDT过程中产生ROS的来源为氧气,然而TME乏氧条件极大地限制了ROS的产生;此外,TME中高表达的GSH作为细胞内抗氧化剂,可以增强ROS的清除率。因此,可以通过耗竭GSH和缓解TME乏氧巩固并提升SDT的治疗效果。基于以上策略,Liang等[24]开发了氢化中空的Pt-TiO₂异质结(H-Pt-TiO₂)。修饰的Pt作为纳米酶催化内源性的H₂O₂分解产生O₂缓解肿瘤的乏氧环境,从而增强SDT的治疗效果。此外,有研究者合成了富含氧缺陷的MnWOₓ-PEG,MnWOₓ表面的W⁶⁺可以被GSH还原为W⁵⁺,因此,MnWOₓ-PEG能够通过消耗GSH提升SDT的治疗效果[25-26]。
2 无机声敏剂在肿瘤治疗中的应用
相较于有机声敏剂,无机声敏剂具有稳定性好和化学物理性质可控等优势,在肿瘤治疗方面展现出极大的应用潜力。目前,发展最成熟的无机声敏剂是钛基声敏剂(最常见的是基于TiO₂的声敏剂),其次是基于其它金属的声敏剂,还有一部分是非金属基声敏剂。在无机声敏剂的开发过程中,通常通过调控无机声敏剂的结构和组成促进US诱导的电子与空穴分离,提高ROS的产生效率,进而增强SDT的治疗效果。
2.1 钛基声敏剂
2011年,Harada等[27]首次报道了纯TiO₂在超声照射下对黑色素瘤细胞(B16F10)和皮下实体瘤的SDT治疗效果。此后,基于TiO₂的声敏剂研究进入了快速发展时期。2012年,Ninomiya等[28]采用乙型肝炎病毒X蛋白的一部分修饰TiO₂,实现了对肝癌HepG2细胞的特异性识别,从而进行SDT。然而,TiO₂作为声敏剂具有一些局限性,如电子-空穴的快速复合((50±30)ns)导致ROS产率较低及带隙宽(3.2 eV)等问题[1,29]。针对以上问题,研究者提出了不同的解决方法。
当金属纳米颗粒(如Au、Pt)与TiO₂复合或者在TiO₂中掺杂金属离子时,可以显著提高ROS产率,进而增强SDT的治疗效果。2016年,Deepagan等[30]通过在TiO₂表面沉积金纳米颗粒(Au NPs)增强SDT的治疗效果,考察了负载小颗粒、小大颗粒和大颗粒Au的TiO₂(3种代表性复合物分别命名为NCs-1、NCs-2和NCs-3,如图3A所示)对SDT治疗效果的影响。该研究发现水介质中的声致发光强度在较短波长处较高。小颗粒Au能够增加较短波长区域(<450 nm)中的吸光度,并将激发的电子泵入TiO₂,但是,由于小颗粒Au态密度低不能充当电子陷阱以防止电子-空穴复合;大颗粒Au可以充当电子陷阱,但是其等离子体诱导的电子注入仅发生在可见光区域(>500 nm)。因此,小大颗粒Au共载的TiO₂的SDT治疗效果比只负载其中一种的效果更显著(图3B)。2020年,Bai等[31]通过在TiO₂中掺杂铁离子得到Fe-TiO₂,由于铁离子的掺杂使得TiO₂的带隙从3.2 eV减小到2.8 eV,Fe-TiO₂纳米点表现出比纯TiO₂更好的SDT治疗效果。类似地,V⁵⁺和Gd³⁺掺杂都可以赋予TiO₂更优的SDT性能[32-33]。
改变TiO₂的形态结构也可以提高SDT的治疗效果。2019年,Feng等[34]报道了一种装载自噬抑制剂、癌细胞膜包被的基于中空介孔二氧化钛纳米颗粒的仿生纳米平台(CCM-HMTNPs/HCQ)。硫酸羟氯喹(HCQ)可以干扰细胞内Notch 1的运输和信号传导,从而表现出血管正常化效应(图3C),缓解了肿瘤缺氧,增强了强氧依赖性HMTNPs介导的SDT的治疗效果。
构造缺陷是巩固声敏剂产生ROS性能的有效手段。2018年,Han等[35]在TiO₂表面覆盖一层TiO₂₋ₓ得到黑色核壳结构的无序晶体(TiO₂@TiO₂₋ₓ)。在外部超声照射下,具有丰富氧缺陷的TiO₂₋ₓ层可以促进能带结构中电子与空穴分离,显著提高SDT的治疗效果。2020年,Wang等[36]设计了超细的PEG-TiO₁₊ₓ纳米棒用于增强SDT。如图3D所示,PEG-TiO₁₊ₓ的带隙(2.05 eV)低于TiO₁₊ₓ/TiO₂纳米复合物(2.28 eV)和TiO₂ NRs(2.98/3.2 eV),这可能是因为缺氧诱导的缺陷态与半导体带边的重叠。以上研究表明,TiO₁₊ₓ作为电荷陷阱限制了电子-空穴对复合,更有效地产生活性氧,提高了SDT的性能。
除了TiO₂基声敏剂,科研人员还开发出了其它钛基化合物声敏剂。2021年,Geng等[37]通过在Ti₃C₂Tₓ表面进一步组装GSH响应的碳点(CDs)得到CD@Ti₃C₂Tₓ杂化异质结,用于深部肿瘤的高效SDT治疗。CDs的价带顶(VBM)位于Ti₃C₂Tₓ的价带顶(VBM)上,形成能量差,驱动激发电子从CDs快速迁移到Ti₃C₂Tₓ纳米片。转移到Ti₃C₂Tₓ上的活化电子将进一步与氧气反应,产生大量的¹O₂。在CD@Ti₃C₂Tₓ界面处形成电子流,有效增强了电子转移,阻止了电子空穴复合,显著提高了Ti₃C₂Tₓ的ROS生成能力。2022年,Li等[38]开发了Ti₃C₂纳米片声敏剂,实现了光热增强的SDT。除了碳化钛外,科研人员还设计了其它钛基半导体,以期得到更好的SDT治疗效果。通过液相剥离法制备的氢化钛TiH₁.₉₂₄纳米点[39]以及TiN纳米点[40]均能够通过减小带隙,抑制电子-空穴复合,实现SDT高效治疗效果。
联合/协同治疗也是提高声敏剂肿瘤治疗效果的有效途径。2019年,Gao等[41]合成了二氧化钛包覆的金纳米片异质结构(Au NPL@TiO₂),实现了光热治疗和SDT的协同治疗。此外,在V-TiO₂中,V⁵⁺可以催化H₂O₂生成·OH,实现化学动力学与SDT的协同治疗。2015年,Shi等[42]研制了一种新型介孔二氧化钛纳米颗粒,负载多西紫杉醇(DTX),再以β-环糊精(β-CD)封口得到DTX@mTiO₂-β-CD,在超声触发下DTX被释放,实现了化学治疗和SDT治疗。2021年,Tan等[43]合成了一种可转化的核壳纳米超声增敏剂(TiO₂@CaP)与抗PD-L1抗体组合使用,实现了SDT与免疫治疗的协同治疗。
2.2 其它金属基声敏剂
随着SDT研究不断发展,其它金属基声敏剂也相继出现。从金属种类方面,已报道的作为声敏剂的金属元素包括Zn、Mo、Bi、Sn、V、Au、Ag、Pt、Co、Ni和Cu等;按化合物种类分类,大致可分为金属氧化物、金属硫(属)化物以及复合物声敏剂等。
其它金属基声敏剂多数为金属氧化物,金属氧化物声敏剂又可分为单金属氧化物和双金属氧化物。2020年,Liu等[44]采用缺陷工程合成了Gd³⁺掺杂的氧化锌纳米子弹(D-ZnOₓ:Gd)。D-ZnOₓ:Gd具有丰富的氧空位,能够提供电子俘获位点,促进超声照射后电子与空穴的分离。此外,D-ZnOₓ:Gd对氧气和水分子具有更强的吸附作用,能够进一步增强ROS产生能力。D-ZnOₓ:Gd在近红外二区(NIR-Ⅱ)生物窗口具有良好的吸收,在NIR-Ⅱ激光照射下能有效地将光转化为热,进一步消除肿瘤细胞。Wang等[45]合成了MoOₓ-PEG,MoOₓ中的“x”值约为2.8(图4A和4B),表明MoO₃中存在多价Mo元素和氧缺陷。如图4C和4D所示,与GSH共孵育后,Mo的价态整体降低,氧空位比例增加,以上结果都证明了GSH具有还原性。如图4E所示,MoOₓ的氧空位可以显著延迟电子-空穴对的复合,有利于提高ROS的产生水平,增强SDT。Cao等[46]开发了氧化铋纳米超声增敏剂(Bi-HJ),在Bi-HJ中同时构建了肖特基异质结和氧空位,促进了超声触发的电子-空穴对分离,提高了电荷利用效率。此外,Bi-HJ具有多孔结构,可以负载代谢调节药物阿托伐醌(ATO)以阻断线粒体呼吸,导致耗氧量减少,增强SDT的治疗效果。2021年,Dong等[47]合成了Bi₂MoO₆纳米带(BMO NRs)。BMO NRs可以消耗GSH,破坏氧化还原稳态;其氧空位还可作为电子捕获位点抑制电子-空穴对重组;超声波还导致压电极化和能带倾斜。基于以上原因,BMO NRs具有出色的产生ROS的能力。2023年,Zhang等[48]开发了ZnSnO₃:Nd纳米粒子。利用Nd³⁺取代Zn²⁺使得O 2p非键合态向费米能级移动,减小带隙。不等电荷取代还可以形成电子陷阱和氧空位,缩短电子迁移距离,加速电子-空穴分离,抑制载流子复合,提高声灵敏度,增强SDT效应。
近年来,金属硫属化物声敏剂也被广泛研究。Liang等[49]设计了多功能的Pt-VS₄。由于VS₄具有窄带隙(1.5 eV),其电子和空穴在超声照射下可以轻易分离,产生¹O₂。助催化剂铂有助于捕获电子,GSH则可捕获空穴,因而Pt-VS₄复合材料可以延长电荷的寿命,高效产生ROS。Li等[50]将Pluronic F-127修饰的Ag₂S量子点包裹在红细胞囊泡中得到(Ag₂S QDs@P)RBC,利用Ag₂S量子点作为声敏剂产生¹O₂,红细胞中的过氧化氢酶催化内源性H₂O₂分解产生O₂,改善肿瘤缺氧,实现酶增强的SDT。除此之外,其它金属硫属化合物也被研究用于恶性肿瘤的SDT治疗。本研究组开发了一种富含缺陷的非晶态IrTe₂(G-IrTe₂)声敏剂[51]。在超声波刺激下,非晶态IrTe₂中Ir-Te键极易断裂,释放的自由电子与氧气反应生成单线态氧(¹O₂)。G-IrTe₂具有类过氧化氢酶活性,能够催化H₂O₂分解提供丰富的氧气,增强SDT的治疗效果。
除了上述基于金属化合物的声敏剂外,还有基于单一金属的声敏剂以及复合声敏剂。2022年,Feng等[52]开发了集声动力和催化效应于一个活性中心的铜纳米点(Cu NDs)。如图4F所示,Cu NDs中的Cu占据两种类型的非等效晶体学位置,包含八面体铜(OCT CuⅡ)和三角双锥铜(TBP CuⅡ)。在超声诱导声致发光条件下,超声通过光电流触发Cu NDs的电子发射,导致高能电子-空穴对分离,并伴随低能电子-空穴对雪崩。来自TBP CuⅡ的超声激活电子转移到每个相邻的OCT CuⅡ,产生OCT CuⅠ(电子)和TBP CuⅢ(空穴)。当电子下降到最低的未占据带(LUMO)OCT CuⅠ时,无法返回到相邻的TBP CuⅢ。O₂和H₂O得到因上述过程而产生的能量以产生ROS。因此,超声诱导的CuⅡ到CuⅠ的转变可以催化H₂O₂转化为·OH;同时,价态转变导致的电子-空穴对的分离促进了用于SDT的ROS的产生。2023年,Zhang等[53]合成了Au@Co₃O₄-PVP(AC-PVP)作为金基声敏剂,在超声下可以产生·O₂⁻和·OH。此外,Au@Co₃O₄还可以作为葡萄糖氧化酶催化葡萄糖产生H₂O₂,Co₃O₄具有类过氧化氢酶活性,催化H₂O₂产生氧气,Co₃O₄还可降低细胞内GSH水平,防止生成的ROS被GSH消耗,进一步增强ROS依赖性SDT的效果。
2.3 非金属基声敏剂
基于非金属纳米结构的无机声敏剂目前也有少量研究。2014年,Osminkina等[54]制备了硅纳米颗粒(SiNPs),SiNPs可作为超声诱导抑制Hep-2癌细胞活力(图5A)。2018年,Jiang等[55]首次合成了基于黑磷(BP)纳米片的2D声敏剂。如图5B所示,BP纳米片是二维半导体,具有高效的单重态-三重态交叉和激发三重态的长寿命(高达14.5 μs),这有助于其与氧气相互作用产生¹O₂。2020年,Li等[56]研究了黑磷纳米片在超声下的ROS产生性能。如图5C所示,对于固有能带不利于ROS产生的BP,超声波将机械应变引入BP纳米片,导致能带倾斜,有利于产生ROS。
3 无机声敏剂在肿瘤成像诊断中的应用
肿瘤的早发现和早治疗具有重大的临床意义,能够显著改善预后和提高生存率。肿瘤的诊疗一体化也成为目前的研究热点之一。目前,利用无机声敏剂进行成像诊断的方式主要包括计算机断层扫描成像(CT)、磁共振成像(MRI)、超声成像(USI)、光声成像(PAI)和荧光成像(FLI)等。
CT成像根据不同器官对X射线的吸收或衰减能力不同,利用计算机处理从不同角度采集的X射线图像的组合,形成扫描对象的解剖图片。目前,具备CT成像和SDT功能的无机诊疗一体化试剂主要是基于具有高X射线吸收系数的元素所制备的纳米材料。Dong等[47]设计了Bi₂MoO₆纳米带(BMO NRs),由于高原子序数的Bi元素具有超高的X射线衰减能力,因此BMO NRs能够实现对比增强的CT成像(图6A和6B)。同样,铋基纳米声敏剂(Bi-HJ)也具有CT成像能力[46]。此外,含有稀土元素[48,57]、Au[23]和Ag[58]等元素的无机声敏剂也能够实现CT成像。
MRI是体内氢质子在外磁场作用下沿着一个方向排列,施加射频脉冲后质子自旋偏转,在恢复到初始状态的过程中即可产生纵向弛豫时间T₁和横向弛豫时间T₂,经过采集编码计算反映组织结构的T₁和T₂值的信号即可得到MRI图像。MRI造影剂可分为T₁磁共振造影剂、T₂磁共振造影剂以及T₁/T₂双加权造影剂。T₁和T₂弛豫时间与磁性有关,产生磁性的条件是具有未成对电子,因此含有Fe、Gd和Mn等元素的无机声敏剂成为了MRI成像造影剂的候选材料。如图6C~6E所示,Fe-TiO₂ NDs中铁离子的掺杂不仅增强了TiO₂本身的SDT性能,还赋予该纳米点MRI成像能力[31]。同样,Gd³⁺离子的掺杂也可以得到SDT性能更优的具有MRI成像能力的声敏剂[33]。
USI通过USI造影剂对超声波的强散射线来提高超声成像的清晰度和分辨率。USI造影剂主要分为以下三类:基于气体(微泡)的USI造影剂、具有特殊形状或结构的纳米材料和具有液体核和固体壳的复合纳米粒子。2020年,Pan等[59]制备了双层空心硅酸锰纳米颗粒(DHMS),光学显微镜图像显示在pH 6.8条件下产生的气泡量最大(图6F~6H)。对于含有H₂O₂和DHMS的溶液,捕获的USI图像对比度显著增强,表明DHMS可作为USI造影剂。
PAI的原理是激光照射内源性发色团或外源性造影剂使得光子能量转化为热量,从而导致膨胀产生超声波,根据超声波信号可以重建出组织的光吸收分布图像。常用的PAI造影剂分为两类:(1)基于内源性发色团的造影剂,如黑色素和血红蛋白等;(2)具有高稳定性的外源性造影剂,即具有高光学吸收系数和高光热转换效率的分子或纳米材料。Meng等[60]合成了具有优异的近红外吸收和光热性能的Bi₂S₃₋ₓ-Au@HA。由图6I可知,Bi₂S₃₋ₓ-Au@HA注射12 h后肿瘤部位的PAI信号达到最大值,表明Bi₂S₃₋ₓ-Au@HA可作为NIR-II PAI造影剂。
FLI是指在激光照射下电子从基态跃迁到激发态而后又返回基态时,以光子释放能量,发出荧光用以成像。Yang研究组[57]报道了类西瓜结构的声敏剂ZnSnO₃@UCNPs(NaYF₄:19%Yb,4.78%Tm,1.2%Er记为UCNPs)。由于ZnSnO₃@UCNPs中存在Er³⁺,在980 nm激发下能够实现1530 nm的近红外发光,进而实现深层组织穿透,用于NIR-Ⅱ区荧光成像。如图6J~6K所示,NIR-Ⅱ荧光强度与ZnSnO₃@UCNPs的浓度呈线性相关,静脉注射12 h后,小鼠肿瘤部位的荧光信号达到最大值。此外,Yang研究组还报道了钙钛矿型的ZnSnO₃:Nd[48],Nd³⁺掺杂能够实现位于1060 nm的NIR-Ⅱ区荧光发射,使其可作为NIR-Ⅱ荧光成像造影剂。
除上述的单一模式成像外,无机声敏剂还能够实现双模式成像,为临床诊断提供更多的信息。2019年,Zhong等[61]制备了具有PAI/CT双模成像能力的PtCu₃-PEG纳米笼。由于PtCu₃-PEG在近红外区具有高的吸光度,因此PtCu₃-PEG可用作PAI造影剂,并且PAI信号可在肿瘤区域持续至少72 h(图7A);由于Pt强大的X射线衰减能力,PtCu₃-PEG还可作为CT成像造影剂(图7B)。同年,Lin等[62]设计合成了PEG和ROS敏感聚合物包覆Janus Au-MnO纳米粒子形成纳米囊泡(JNP Ves)。在超声刺激下,囊泡分解为较小的Au-MnO纳米粒子,随后ROS引发聚合物降解,释放出Mn²⁺和Au。采用原位肝荷瘤小鼠模型证明了JNP Ves的体内治疗和成像效果(图7C)。如图7D所示,降解释放的Mn²⁺可作为T₁加权MRI造影剂,静脉注射后,随时间延长,肿瘤T₁信号强度显著增加。此外,该智能纳米平台还实现了NIR-Ⅱ区的PAI成像。如图7E所示,分别检测了808和1260 nm处的PAI图像,后者显示出可忽略的背景干扰和精确的肿瘤定位能力。如图7F所示,注射JNP Ves后,1260 nm处的PAI信号随时间延长而增加,表明JNP Ves具有高肿瘤积累和渗透率。因此,采用Janus Au-MnO实现了MRI/PAI双模成像。
目前报道的无机声敏剂已能够实现肿瘤的CT、MRI、FLI、PAI和USI等成像诊断。通常情况下,含有高X射线吸收系数元素的无机声敏剂具有良好的CT成像效果。若无机声敏剂含具有未成对电子的Fe、Gd、Mn等元素,能够实现T₁或T₂加权MRI。FLI要求无机声敏剂具有荧光发射,特别是近红外荧光发射。具有高光学吸收系数和高光热转换效率的无机声敏剂通常具有良好的PAI能力。能够实现USI的无机声敏剂一般具有特殊的结构。目前,无机声敏剂用于CT和MRI肿瘤诊断的研究已较普遍,能够实现FLI和PAI的无机声敏剂的报道相对较少,而用于肿瘤USI的无机声敏剂则有待进一步研究和开发。
4 总结与展望
无机声敏剂的结构和性能稳定,制备方法多样,具有可调控的肿瘤靶向性,相较于有机声敏剂具有诸多优势。本文按照无机声敏剂的分类对其在肿瘤治疗方面的研究进展进行了评述。此外,按照成像方式的不同,综述了无机声敏剂在肿瘤成像诊断方面的进展。基于SDT的作用机理,可以通过掺杂、组分和结构调控、构造缺陷等手段对无机声敏剂进行合理的材料设计,实现高效的SDT和高分辨的成像诊断。虽然无机声敏剂的研究已取得了很大的进步,但其在以下方面还需要进一步探索和优化。(1)无机声敏剂依然存在靶向能力差、敏化效率低和治疗机制不够清楚等问题。对此,开展跨学科合作研究可能是较好的选择。(2)制备生物安全的无机声敏剂纳米平台至关重要,应全面系统地评价声敏剂的长期毒性、急性毒性、生殖毒性、药代动力学等毒性和药理作用,促进声敏剂发展。(3)由于超声波具有深层组织穿透性,SDT具有广阔的临床应用前景,目前关于声敏剂的临床研究主要集中在有机物,无机声敏剂的临床研究严重缺乏,对于无机声敏剂在SDT中的临床应用性和有效性的认识还有限。因此,需要对更多的临床样本进行研究,以提高SDT的普适性和治疗效果。
参考文献
[1] XU T, ZHAO S, LIN C, ZHENG X, LAN M. Nano Res. , 2020, 13(11): 2898-2908.
[2] SANDEEP T C, STRACHAN M W J, REYNOLDS R M, BREWSTER D H, SCLO G, PUKKALA E, HEMMINKI K, ANDERSON A, TRACEY E, FRIIS S, MCBRIDE M L, KEE-SENG C, POMPE-KIRN V, KLIEWER E V, TONITA J M, JONASSON J G, MARTOS C, BOFFETTA P, BRENNAN P. J. Clin. Endocrinol. Metab. , 2006, 91(5): 1819-1825.
[3] UTADA M, OHNO Y, HORI M, SODA M. Cancer Sci. , 2014, 105(7): 890-896.
[4] YUMITA N, NISHIGAKI R, UMEMURA K, UMEMURA S. Jpn. J. Cancer Res. , 1989, 80(3): 219-222.
[5] XING X, ZHAO S, XU T, HUANG L, ZHANG Y, LAN M, LIN C, ZHENG X, WANG P. Coord. Chem. Rev. , 2021, 445: 214087.
[6] ZHAO Ya-Jie, XIAO Xiao, MA Ping-An, LIN Jun. Chin. J. Anal. Chem. , 2021, 49(12): 2015-2022. 赵雅洁, 肖霄, 马平安, 林君. 分析化学, 2021, 49(12): 2015-2022.
[7] OHMURA T, FUKUSHIMA T, SHIBAGUCHI H, YOSHIZAWA S, INOUE T, KUROKI M, SASAKI K, UMEMURA S I. Anticancer Res. , 2011, 31(7): 2527-2533.
[8] YUMITA N, UMEMURA S. J. Pharm. Pharmacol. , 2004, 56(1): 85-90.
[9] CHEN Z, LI J, SONG X, WANG Z, YUE W U. Exp. Ther. Med. , 2012, 3(2): 273-278.
[10] ZHENG X, LIU W, GE J, JIA Q, NAN F, DING Y, WU J, ZHANG W, LEE C S, WANG P. ACS Appl. Mater. Interfaces, 2019, 11(20): 18178-18185.
[11] LIU H, ZHENG T, ZHOU Z, HU A, LI M, ZHANG Z, YU G, FENG H, AN Y, PENG J, CHEN Y. RSC Adv. , 2019, 9(19): 10528-10535.
[12] LIU B, WANG J, WANG X, LIU B M, KONG Y M, WANG D, XU S K. J. Fluoresc. , 2010, 20(5): 985-992.
[13] LIU B, WANG D J, WANG X, LIU B M, KONG Y M, HE L L, WANG J, XU S K. Spectrochim. Acta, Part A, 2011, 78(2): 712-717.
[14] LIN X H, SONG J B, CHEN X Y, YANG H H. Angew. Chem. Int. Ed. , 2020, 59(34): 14212-14233.
[15] QIAN X Q, ZHENG Y Y, CHEN Y. Adv. Mater. , 2016, 28(37): 8097-8129.
[16] JUZENAS P, JUZENIENE A, KAALHUS O, IANI V, MOAN J. Photochem. Photobiol. Sci. , 2002, 1(10): 745-748.
[17] ZHAO W, ZHAO Y M, WANG Q F, LIU T Q, SUN J J, ZHANG R. Small, 2019, 15(45): 1903060.
[18] ZHU P, CHEN Y, SHI J. ACS Nano, 2018, 12(4): 3780-3795.
[19] PANG X, XU C S, JIANG Y, XIAO Q C, LEUNG A W. Pharmacol. Ther. , 2016, 162: 144-151.
[20] HASSAN M A, CAMPBELL P, KONDO T. Drug Discovery Today, 2010, 15(21-22): 892-906.
[21] UM W, KIM E K, PARK K, LEE J, KIM C H, YOU D G, PARK J H. Chem. Commun. , 2021, 57(23): 2854-2866.
[22] JIN H, ZHONG X, WANG Z Y, HUANG X, YE H Y, MA S Y, CHEN Y, CAI J Y. J. Cell. Biochem. , 2011, 112(1): 169-178.
[23] CAO Y, WU T T, DAI W H, DONG H F, ZHANG X J. Chem. Mater. , 2019, 31(21): 9105-9114.
[24] LIANG S, DENG X R, XU G Y, XIAO X, WANG M F, GUO X S, MA P A, CHENG Z Y, ZHANG D, LIN J. Adv. Funct. Mater. , 2020, 30(13): 1908598.
[25] CHENG X T, XU H D, RAN H H, LIANG G L, WU F G. ACS Nano, 2021, 15(5): 8039-8068.
[26] GONG F, CHENG L, YANG N, BETZER O, FENG L, ZHOU Q, LI Y, CHEN R, POPOVTZER R, LIU Z. Adv. Mater. , 2019, 31(23): 1900730.
[27] HARADA Y, OGAWA K, IRIE Y, ENDO H, FERIL L B, UEMURA T, TACHIBANA K. J. Controlled Release, 2011, 149(2): 190-195.
[28] NINOMIYA K, OGINO C, OSHIMA S, SONOKE S, KURODA S, SHIMIZU N. Ultrason. Sonochem. , 2012, 19(3): 607-614.
[29] OZAWA K, EMORI M, YAMAMOTO S, YUKAWA R, YAMAMOTO S, HOBARA R, FUJIKAWA K, SAKAMA H, MATSUDA I. J. Phys. Chem. Lett. , 2014, 5(11): 1953-1957.
[30] DEEPAGAN V G, YOU D G, UM W, KO H, KWON S, CHOI K Y, YI G R, LEE J Y, LEE D S, KIM K, KWON I C, PARK J H. Nano Lett. , 2016, 16(10): 6257-6264.
[31] BAI S, YANG N L, WANG X W, GONG F, DONG Z L, GONG Y H, LIU Z, CHENG L. ACS Nano, 2020, 14(11): 15119-15130.
[32] WANG X W, WANG X Y, ZHONG X Y, LI G Q, YANG Z J, GONG Y H, LIU Z, CHENG L. Appl. Phys. Rev. , 2020, 7(4): 041411.
[33] YUAN P, SONG D K. Nanotechnology, 2018, 29(12): 125101.
[34] FENG Q H, YANG X M, HAO Y T, WANG N, FENG X B, HOU L, ZHANG Z Z. ACS Appl. Mater. Interfaces, 2019, 11(36): 32729-32738.
[35] HAN X X, HUANG J, JING X X, YANG D Y, LIN H, WANG Z G, LI P, CHEN Y. ACS Nano, 2018, 12(5): 4545-4555.
[36] WANG X W, ZHONG X Y, BAI L X, XU J, GONG F, DONG Z L, YANG Z J, ZENG Z J, LIU Z, CHENG L. J. Am. Chem. Soc. , 2020, 142(14): 6527-6537.
[37] GENG B J, XU S, SHEN L X, FANG F L, SHI W Y, PAN D Y. Carbon, 2021, 179: 493-504.
[38] LI G, ZHONG X, WANG X, GONG F, LEI H, ZHOU Y, LI C, XIAO Z, REN G, ZHANG L, DONG Z, LIU Z, CHENG L. Bioact. Mater. , 2022, 8: 409-419.
[39] GONG F, CHENG L, YANG N L, GONG Y H, NI Y W, BAI S, WANG X W, CHEN M C, CHEN Q, LIU Z. Nat. Commun. , 2020, 11(1): 3712.
[40] WANG X W, WANG X Y, YUE Q F, XU H Z, ZHONG X Y, SUN L N, LI G Q, GONG Y H, YANG N L, WANG Z H, LIU Z, CHENG L. Nano Today, 2021, 39: 101170.
[41] GAO F L, HE G L, YIN H, CHEN J, LIU Y B, LAN C, ZHANG S R, YANG B C. Nanoscale, 2019, 11(5): 2374-2384.
[42] SHI J J, CHEN Z Y, WANG B H, WANG L, LU T T, ZHANG Z Z. ACS Appl. Mater. Interfaces, 2015, 7(51): 28554-28565.
[43] TAN X, HUANG J, WANG Y, HE S, JIA L, ZHU Y, PU K, ZHANG Y, YANG X. Angew. Chem. Int. Ed. , 2021, 60(25): 14051-14059.
[44] LIU Y, WANG Y, ZHEN W, WANG Y, ZHANG S, ZHAO Y, SONG S, WU Z, ZHANG H. Biomaterials, 2020, 251: 120075.
[45] WANG Y J, GONG F, HAN Z H, LEI H L, ZHOU Y K, CHENG S N, YANG X Y, WANG T Y, WANG L, YANG N L, LIU Z, CHENG L. Angew. Chem. Int. Ed. , 2023, 62(9): e202215467.
[46] CAO X Y, WANG Y, SONG X R, LOU W Q, LI X Y, LU W P, CHEN K, CHEN L, CHEN Y, HUANG B C. Adv. Funct. Mater. , 2023, 33(25): 2300777.
[47] DONG Y S, DONG S M, LIU B, YU C H, LIU J, YANG D, YANG P P, LIN J. Adv. Mater. , 2021, 33(51): 2106838.
[48] ZHANG R, ZANG P Y, YANG D, LI J H, HU N, QU S N, YANG P P. Adv. Funct. Mater. , 2023, 33(25): 2300522.
[49] LIANG S, LIU B, XIAO X, YUAN M, YANG L, MA P, CHENG Z, LIN J. Adv. Mater. , 2021, 33(36): 2101467.
[50] LI C, YANG X Q, AN J, CHENG K, HOU X L, ZHANG X S, HU Y G, LIU B, ZHAO Y D. Theranostics, 2020, 10(2): 867-879.
[51] WEN D, LI K, DENG R, FENG J, ZHANG H. J. Am. Chem. Soc. , 2023, 145(7): 3952-3960.
[52] FENG W, LIU Z L, XIA L L, CHEN M, DAI X Y, HUANG H, DONG C H, HE Y, CHEN Y. Angew. Chem. Int. Ed. , 2022, 61(48): e202212021.
[53] ZHANG M F, DONG L L, LI D, ZHU L C, PENG R M, LIU X J, WANG K Y, WANG X, ZHU Y C, SUN H T, LUO Y. Adv. Funct. Mater. , 2023, 33(41): 2303451.
[54] OSMINKINA L A, SIVAKOV V A, MYSOV G A, GEORGOBIANI V A, NATASHINA U А, TALKENBERG F, SOLOVYEV V V, KUDRYAVTSEV A A, TIMOSHENKO V Y. Nanoscale Res. Lett. , 2014, 9(1): 463.
[55] JIANG O Y, LIU D, CHEN W S, SHENG J P, LIU Z J, WANG L Q, LIU Y N. Chem. Commun. , 2018, 54(23): 2874-2877.
[56] LI Z Y, ZHANG T M, FAN F, GAO F, JI H X, YANG L H. J. Phys. Chem. Lett. , 2020, 11(4): 1228-1238.
[57] ZHANG R, YANG D, ZANG P Y, HE F, GAI S L, KUANG Y, YANG G X, YANG P P. Adv. Mater. , 2023, 36(9): 2308355.
[58] CHENG K, ZHANG R Y, YANG X Q, ZHANG X S, ZHANG F, AN J, WANG Z Y, DONG Y, LIU B, ZHAO Y D, LIU T C. ACS Appl. Mater. Interfaces, 2020, 12(36): 40052-40066.
[59] PAN X T, WANG W W, HUANG Z J, LIU S, GUO J, ZHANG F R, YUAN H J, LI X, LIU F Y, LIU H Y. Angew. Chem. Int. Ed. , 2020, 59(32): 13557-13561.
[60] MENG N Q, XU P J, WEN C C, LIU H H, GAO C J, SHEN X C, LIANG H. J. Colloid Interface Sci. , 2023, 644: 437-453.
[61] ZHONG X Y, WANG X W, CHENG L, TANG Y A, ZHAN G T, GONG F, ZHANG R, HU J, LIU Z, YANG X L. Adv. Funct. Mater. , 2020, 30(4): 1907954.
[62] LIN X H, LIU S Y, ZHANG X, ZHU R, CHEN S, CHEN X Y, SONG J B, YANG H H. Angew. Chem. Int. Ed. , 2020, 59(4): 1682-1688.

 >
>