胆固醇氧化酶的三相分离及其血清总胆固醇的测定
时间:
摘要:对一株胞外胆固醇氧化酶高产菌 COX4 8 进行了三相分离,结果表明:最优分离条件为:硫酸铵 异丙醇沉淀,硫酸铵饱和度为 70%,异丙醇与发酵上清液的体积比为 0.8∶1 时,pH 值为 9,在 20 ℃下静置 3 0 min,1 2 000 r/min 离心 1 0 min,纯化倍数 4.5 倍,回收率高达 9 5%.酶动力学方法检测胆固醇氧化酶测定血清总胆固醇含量, 其线性回归方程为 y=0.00 6 4x+0.002 7,R 2 =0.9 6 5 4,线性范围 0~7.1 6 mmol/L.结果表明了该酶具有作为临床诊断试剂的潜力,并为临床上利用酶动力学方法测定血清总胆固醇含量奠定了实验基础.
关 键 词:胆固醇氧化酶;三相分离;酶动力学方法
胆固醇是脊椎动物细胞膜的重要组成成分,它具有多种多样的生理功能.但是体内过多的胆固醇却是引起冠心病、动脉硬化和心肌梗塞的危险因素之一.目前欧美等发达国家冠心病的死亡率已经超过所有癌症死亡率的总和,占总死亡率的 2 7.4% [1].
胆固醇氧化酶(COD)能够催化胆固醇氧化成为胆甾 4 烯 3 酮.因此可以用它来检测血液中胆固醇的含量.它可以分解食物中的胆固醇,已经应用在心血管疾病的治疗当中[2-4].另外,它还能有效抑制鳞翅目昆虫的生长繁殖,是一种生物杀虫剂[5].它的氧化产物还具有抗肥胖、治疗肝病等疗效[6]. 三相分离技术(TPP)是将硫酸铵与有机溶剂混合后形成有机相、中间沉淀相和水相的原理而用于分离蛋白质的技术.常用于三相分离的有机溶剂有乙醇、丙酮、异丙醇、甲醇等,有机溶剂的用量一般为酶液体积的 2 倍左右,使用不同的酶和不同的有机溶剂时,有机溶剂的使用浓度都有所不同,同时该技术还受温度和 pH 的影响[7].
本研究采用了实验室保存菌中筛选得到 1 株胞外胆固醇氧化酶高产菌 COX4 8,三相分离用于纯化胆固醇氧化酶的最合适的体系是当V(异丙醇)∶V(发酵上清液)为 0.8∶1,硫酸铵饱和度为 70%;最适提取温度和时间分别为 20 ℃,3 0 min,最适 pH 值为 9.0,并采用酶动力学方法检测胆固醇氧化酶测定血清总胆固醇含量,对其准确性进行了分析.其线性回归方程为 y =0.00 6 4x+0.002 7,R 2 =0.9 6 5 4,线性范围 0~7.1 6 mmol/L.结果表明了该酶具有作为临床诊断试剂的潜力,并为临床上利用酶动力学方法测定血清总胆固醇含量奠定了实验基础.
1 材料与方法
1.1 胆固醇氧化酶的来源
四川师范大学分子生物与微生物研究室保存产胆甾 4 烯 3 酮的菌株 COX4 8(Rhodococcuse sp.) 发酵所产的胆固醇氧化酶的粗酶液.
1.2 主要药品
胆固醇(国药)、辣根过氧化物酶(国药)、TritonX 1 00(进口分装)、胆固醇氧化酶(SIGMA)、4 氨基氨替比林(国药)、胆固醇酯酶(实验室保存)、测定血清总胆固醇含量的试剂盒(长春汇力生物技术有限公司)、人血清标本(四川省第二中医医院).酵母粉、大豆蛋白胨(OXOID)、硫酸铵、正丙醇、异丙醇、正丁醇、叔丁醇、丙酮(均为国产药品).
1.3 酶活力测定的试剂和工作液
1.3.1 1 00×4 氨基 氨替比林(4 AA)溶液
称取 2.0 3 2 4 g 4 氨基 氨替比林溶于超纯水中,最后定容至 1 00 mL,用棕色瓶装,4 ℃避光保存.
1.3.2 1 00×叠氮钠溶液
称取 2 g 叠氮钠溶于超纯水中定容至 1 00 mL,用棕色瓶装,4 ℃避光保存.
1.3.3 A 液
分别加入 1 ml 1 00×4 AA 溶液(终浓度为 1 mmol/L),1 mL 1 00×叠氮钠溶液(终浓度为 0.2 g/L), 5 6 μL 重蒸酚(终 浓 度 为 6 mmol/L),700 U 辣 根 过 氧 化 物 酶 (终 浓 度 为 7 000 U/L),用 2 5 mmol/L、 pH7.5 的磷酸钾缓冲液定容至 1 00 mL.
1.3.4 胆固醇底物溶液(B 液)
胆固醇需先用碾钵碾细(便于溶解),称取 0.1 6 5 2 g 胆固醇溶于异丙醇中,同时加入 TritonX 1 00(最终体积分数为 4.2 6%)助溶,然后用异丙醇定容至 20 mL,4 ℃密封保存.
1.4 制作胆固醇标准曲线试剂配制
1.4.1 C 液[8]
4 氨基 安替比林:0.5 mmol/L;重蒸酚:20 mmol/L;胆酸钠:0.5 mmol/L;辣根过氧化物酶: 1 0 000 U/L;磷酸钾缓冲液:0.1 mol/L,pH7.0;TritonX 1 00:9 g/L;不同酶活单位的胆固醇氧化酶.
1.4.2 D 液[8]
将一系列不同底物浓度(0 ~2 5.6 mmol/L)的底物胆固醇溶于乙醇中,其中加入 TritonX 1 00 助溶 (最终体积分数为 20%).
2 方 法
2.1 胆固醇氧化酶活力测定
操作方法[9]:在小试管中取 3 mL A 液与 15 0 μL B 液混合,3 7 ℃下在恒温水浴锅中保温 3 min,加入 5 0 μL 粗酶液,迅速混匀,3 7 ℃准确反应 5 min,立即沸水浴 3 min,将试管放于冰水中冷却澄清,于 5 00 nm 下测定吸光度.酶活(U/mL)为 1.6 8 3 2×A5 0 0 .
2.2 酶的分离纯化
2.2.1 不同硫酸铵饱和度对酶初步纯化收率的影响
在粗酶液中加入不同饱和度的硫酸铵(40%~9 0%),5 ℃下静置 2 h,1 2 000 r/min,冷冻离心 1 0 min, 收集沉淀,用 pH7.5 的 1 0 mmol/L 的磷酸缓冲液溶解后按照胆固醇氧化酶的测定方法测定酶活和蛋白质浓度.
2.2.2 不同有机溶剂对酶初步纯化收率的影响
在粗酶液中加入不同体积的有机溶剂(正丙醇、异丙醇、正丁醇、叔丁醇、丙酮),5 ℃下静置 2 h, 1 2 000 r/min 冷冻离心 1 0 min,收集沉淀,用 pH7.5 的 1 0 mmol/L 的磷酸缓冲液溶解后按照标准方法测定酶活和蛋白质浓度.
2.2.3 不同有机溶剂对酶三相分离收率的影响
5 ℃条件下,在粗酶液中加入饱和度为 70%的硫酸铵,待溶解后,将不同体积的不同有机溶液加入, 5 ℃下静置 2 h 分为 3 层,1 2 000 r/min 冷冻离心 1 0 min,收集中间的蛋白相,用 pH7.5 的 1 0 mmol/L 的磷酸缓冲液溶解后按照标准方法测定酶活和蛋白质浓度.
2.2.4 温度和时间对酶三相分离的影响
用 2.2.2 的结果,改变三相分离体系的抽提温度(5,1 0,20,2 5,3 0,40 ℃)和时间(1 0,20,3 0,6 0,9 0, 1 20 min),以上述相同方法收集中间蛋白相测定胆固醇氧化酶的酶活和蛋白质浓度.
2.2.5 不同 pH 对酶三相分离的影响
根据 2.2.2 和 2.2.3 的实验结果,对三相分离体系的 pH 环境进行优化,改变上清液的 pH (4~11), 以上述相同方法收集中间蛋白相并测定胆固醇氧化酶的酶活和蛋白质浓度.
2.3 血样的采集与处理
样本来源:四川省第二中医医院采集胆固醇浓度从高到低的 8 个血清标本.
样本处理:采用静脉采样,同时加入 EDTA-Na2 (1 mg/mL)的抗凝剂,尽快送实验室,室温放置 3 0~ 40 min 后,用冷冻离心,得到血清置于洁净的试管中加盖保存.血清标本在室温中放置不超过 3 h,4 ℃保存可稳定 4 d.置-70 ℃可长期保存,但不可反复冻融.
总胆固醇含量的测定:采用测定血清总胆固醇含量的试剂盒,按照试剂盒测定血清总胆固醇含量的方法(终点法),测定血清标本胆固醇的准确浓度.
2.4 动力学方法和终点法测定胆固醇含量
2.4.1 终点法
直接加入 C 液保存 3 min 后,和 D 液准确反应 1 0 min,然后沸水浴 3 min 终止反应,待澄清后于 5 00 nm下测定吸光度.
2.4.2 酶动力学方法
直接加入 C 液保存 3 min 后,每隔 5s 检测一次酶活,最后测出每分钟吸光值的变化.
2.5 酶动力学方法的优化
2.5.1 酶动力学方法
反应体系中胆固醇与反应试剂的比例研究研究发现,在酶动力学反应中,底物在反应体系中的浓度直接影响着胆固醇氧化酶测定胆固醇的准确性,因此在测定血清总胆固醇之前,对反应体系中底物浓度的优化很重要.选取了底物∶反应试剂浓度梯度为 1∶1 00,1∶20,1∶1 0 进行比较研究.
2.5.2 酶动力学方法中不同的胆固醇氧化酶酶活对线性关系的影响
不同的胆固醇氧化酶酶活,在用于测定胆固醇含量时,其准确度也不一样.实验通过比较 1 00 U/L, 200 U/L,400 U/L,800 U/L 这 4 个不同的酶活单位,确定一个最佳的测定胆固醇含量的酶活,为酶动力学方法的构建打好基础.
2.6 动力学方法测定血清总胆固醇含量的准确度研究
2.6.1 胆固醇氧化酶的血清总胆固醇含量标准曲线
用制作胆固醇含量标准曲线的动力学方法,以已知总胆固醇含量的血清为底物(浓度 0~7.1 6 mmol/ L),制作该胆固醇氧化酶的血清总胆固醇含量标准曲线,确定该酶采用动力学方法在检测血清总胆固醇含量的准确性
.2.6.2 酶动力学反应进程的测定
选取 2.5 6 1 mmol/L 和 5.2 mmol/L 两个总胆固醇浓度的血清样本为底物,测定反应 3 0,6 0,1 20,1 80, 2 1 0,240 s 的吸光值变化.
2.7 胆固醇氧化酶测定血清总胆固醇含量的精密度的研究方法
选取低、中、高 3 个总胆固醇浓度的血清样本(2.5 6 1,3.9 5 3,5.2 mmol/L),1 d 内分别做 6 个重复测定该样本的总胆固醇含量,确定该酶的日内精密度;同时连续做 6 d,每天测定一次该样本的总胆固醇含量,确定该酶的日间精密度;最后对血清总胆固醇含量回收率进行检测,在 3 个血清样本中加入相同浓度的相同体积的血清,并混合,然后用上述同样的方法检测该样本中胆固醇的含量,最后计算出该胆固醇氧化酶在用于测定血清总胆固醇含量的回收率.
3 结 果
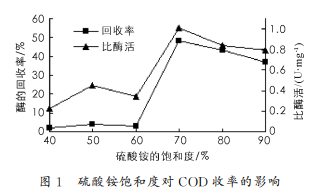
3.1 不同硫酸铵饱和度对酶初步纯化收率的影响
由图 1 可知,硫酸铵饱和度从 40%提高到 70%时,回收率和比酶活都大体成上升的趋势;当硫酸铵的饱和度为 70%时,沉淀的目的酶蛋白达到最多,回收率达 48%,比酶活达 1 U/mg,发酵上清液的比酶活为 0.3 9 U/mg,纯化倍数为 2.5 倍;随后,开始呈下降的趋势.通过对硫酸铵饱和度的优化,确定其最优的沉淀条件,为后面对三相分离的研究提供了条件.
3.2 不同有机溶剂对酶初步纯化收率的影响
利用丙酮、正丙醇、异丙醇、正丁醇、叔丁醇等 5 种有机溶剂分别纯化胆固醇氧化酶,并对其酶的收率进行检测,结果如下:
丙酮沉淀胆固醇氧化酶的结果如图 2 所示,综合胆固醇氧化酶的回收率和比酶活可知,最优的丙酮沉淀条件是:当V(丙酮)∶V(发酵上清液)为 0.4∶1 时,酶回收率达到 7.2 7%,比酶活为 0.1 3 U/mg,发酵上清液的比酶活为 0.1 8 U/mg,纯化倍数为 0.6 9 倍.
正丙醇沉淀胆固醇氧化酶的结果如图 3 所示,综合考虑胆固醇氧化酶的回收率和其比酶活可知,最优的正丙醇沉淀条件是:当V(正丙醇)∶V(发酵上清液)为 0.9∶1 时,酶回收率达到 2.7 9%,比酶活为 0.11 U/mg,发酵上清液的比酶活为 0.1 8 U/mg,纯化倍数为 0.6 倍.
异丙醇沉淀胆固醇氧化酶的结果如图 4 所示,综合考虑胆固醇氧化酶的回收率和比酶活可知,最优的异丙醇沉淀条件是:当V(异丙醇)∶V (发酵上清液)为 0.9∶1 时,酶回收率达到 2.9 9%,比酶活为 0.2 3 U/mg,发酵上清液的比酶活为 0.1 8 U/mg,纯化倍数为 1.2 1 倍.
正丁醇沉淀胆固醇氧化酶的结果如图 5 所示,综合考虑该胆固醇氧化酶的回收率和比酶活可知,最优的正丁醇沉淀条件是:当V(正丁醇)∶V(发酵上清液)为 0.9∶1 时,酶回收率达到 1.45%,比酶活为 0.1 8 U/mg,发酵上清液的比酶活为 0.1 8 U/mg,纯化倍数为 1 倍.
叔丁醇沉淀胆固醇氧化酶的结果如图 6 所示,综合考虑胆固醇氧化酶的回收率和比酶活可知,最优的叔丁醇沉淀条件是:当V(叔丁醇)∶V (发酵上清液)为 0.8∶1 时,酶回收率达到 3.6 8%,比酶活为 0.2 3U/mg,发酵上清液的比酶活为 0.1 8 U/mg,纯化倍数为 1.2 倍.
3.3 不同有机溶剂对酶三相分离收率的影响
对比了丙酮 硫酸铵、正丙醇 硫酸铵、异丙醇 硫酸铵、正丁醇 硫酸铵、叔丁醇 硫酸铵的三相分离对酶回收率的影响,其中使用的硫酸铵饱和度均为 70%.希望通过对不同有机溶剂体积进行优化,获得适合用于胆固醇氧化酶纯化的三相分离体系.
3.3.1 丙酮 硫酸铵沉淀胆固醇氧化酶与收率
如图 7 所示,综合分析胆固醇氧化酶的回收率和比酶活可知,最优的丙酮 硫酸铵沉淀条件是:当 V (丙酮)∶V(发酵上清液)为 0.5∶1 时,酶回收率达到 51.42%,比酶活为 1.2 2 U/mg,发酵上清液的比酶活为 0.3 1 U/mg,纯化倍数为 3.1 倍.
3.3.2 正丙醇 硫酸铵沉淀胆固醇氧化酶与收率
如图 8 所示,综合胆固醇氧化酶的回收率和比酶活可知,最优的正丙醇-硫酸铵沉淀条件是:当V(正丙醇)∶V(发酵上清液)为 0.9∶1 时,酶回收率达到 64.2 6%,比酶活为 1.48 U/mg,发酵上清液的比酶活为 0.3 1 U/mg,纯化倍数为 3.7 5 倍. ——论文作者:王 琼, 霍 影, 汪 静, 张清燕, 任 尧, 葛方兰


