计算机化系统验证方法探讨
时间:
摘要:数据完整性的要求越来越成为各个国家药品监管部门的检查重点,而计算机化系统验证是实现数据完整性的重要一环。本文参考国内外法规和指南,结合工作经验,从概念,计算机化系统验证项目,质量风险管理工具的运用,到验证的原则和方法进行探讨。
关键词:数据完整性;计算机化系统;验证
1概念
1.1计算机化系统组成
计算机化系统由计算机系统和受控功能或者受控流程组成。计算机系统由所有计算机硬件、固件、安装设备和控制操作计算机的软件组成。计算机化系统的受控功能,可能由受控的设备和该设备定义功能的操作程序组成;或者也可能是一种不需要设备(非计算机系统硬件)的操作。通过局域网接口和联网功能,是计算机化系统和与多个计算机和应用程序潜在连接的操作环境的一部分。
在GMP环境下的计算机化系统,必须由经过培训的用户操作系统,且必须遵照批准的,经过验证的规程。验证方法必须基于计算机化系统的关键性和计算机化系统部件,功能的GMP风险制定[1]。这个方法有利于优化资源和时间,以及依据GMP基于风险和生命周期管理(设计/验证/运行/退役)的合规[2]。
1.2软件类别
对于大多数系统,其各组件的复杂性是不一样的,比如操作系统,不可配置(组态)的组件,可配置的组件或定制组件。各组件的关注程度大小为:定制>可配置>不可配置>基础架构(表1)[3]。

2计算机化系统验证项目
2.1验证计划
GAMP类别为4的计算机化系统或者类别5的软件必须要有一份专门的计算机化系统验证计划。验证计划必须符合相关SOP的要求。
2.2基础架构
确认应用程序必须被验证,而IT基础架构必须被确认。IT基础架构的确认是计算机化系统验证的先决条件(单机的计算机化系统除外)。基础架构的确认包括计算机化系统中所有元素(例如服务器、局域网、存储区域网络)的确认。确认过程应通过确认计划和确认报告管理。
2.3供应商确认
GAMP类别为3、4和5的计算机化系统的供应商(包括软件供应商和服务供应商),必须通过QA评估和批准。评估可以通过现场审计和问卷调查的形式进行。审计结果必须被单独记录在一份审计报告中[4]。
2.4数据完整性
为了在用户层面完成数据完整性的合规,工厂至少要有下列流程:审计追踪审核,系统权限控制和用户资料,数据收集,备份和恢复。新计算机化系统的这些流程和他们的适用性必须作为用户需求(URS)的一部分,这样才能在验证阶段核实这些内容[5]。
2.5质量风险管理
2.5.1整体风险评估
整体风险评估要评估法规影响,它是记录对于验证过的计算机化系统做出决定的活动。系统影响基于书面化的理由来决定计算机化系统是否是GMP相关和是否需要验证,决定验证的策略和深度。所有计算机化系统,要从系统层面进行影响评估。评估的内容包括:GMP相关性,电子记录和电子签名,系统供应商,系统关键性和系统复杂性。
2.5.2风险分析报告
对于GAMP分类为4和5的软件,必须准备单独的一份风险分析报告来决定验证测试计划,定义出挑战性测试命名的模块测试和一些补充的行动(例如:SOP,培训,额外的自动控制),它们将会降低系统带来的风险。风险分析在URS批准后,应尽早开始实施。GMP相关的用户需求必须在风险分析中进行评估。风险分析可以采用FMEA等方法[6]。
2.6追踪矩阵
为了连接每一个GMP的要求与其对应的风险项和测试项,必须准备追踪矩阵。所有要求,不仅仅是GMP的要求,都可以在矩阵里连接到测试项。追踪矩阵可以确保所有要求都被测试到。追踪矩阵是计算机化系统生命周期中的一份动态文件,他应该反映计算机化系统URS和测试的当前关系。验证所有人应该在URS批准后立即开始起草追踪矩阵,并将其完成作为一份单独的文件附到验证总结报告中。
2.7验证总结报告
验证总结报告总结所执行的验证活动和发布的文档,以证明验证计划中预见的验证过程已正确执行和完成。分析在验证过程中收集的数据,包括可测量的测试结果和满足验收标准的确认。报告发生的偏差,不合格和后续措施。该报告将对系统验证状态做出一个明确的结论,宣布系统可以释放供操作使用。验证报告还包括主文档列表,它是验证过程中产生的所有验证文档的最终列表。
3计算机化系统验证原则和方法
3.1计算机化系统验证的原则
验证的成功取决于法规的风险评估,计算机化系统复杂性和供应商的评估。当一个新的或是改变的计算机化系统,必须被安装在法规要求的GMP环境下时,该系统的验证程度要在验证计划中体现。
3.2计算机化系统验证流程
1)新的或是改造的计算机化系统提议变更:任何新的GMP相关的计算机化系统或者是改变已经验证过的计算机化系统必须通过变更管理流程控制。
2)评估法规适用性:评估必须决定验证是否需要,这取决于相关GMP法规对该计算机化系统的适用性。所有新的计算机化系统必须要评估GMP的状态(非GMP系统还是GMP系统)。GMP的计算机化系统需要验证。
3)评估系统关键和复杂性,可以按实验室系统和过程控制系统区分来评估。
4)评估供应商:GAMP类别为3、4和5的计算机化系统软件供应商必须经过评估。评估的方法可以选择现场审计和问卷调查,但GAMP分类为5的计算机化系统供应商,必须执行现场审计。评估的结果需要记录在验证计划中。
5)升版CS清单和准备CS验证计划:计算机化系统必须记录在工厂CS清单里。基于以上风险分析,验证计划将决定对于新的或是改造的计算机化系统执行哪些验证项目。对于不同GAMP类别的计算机化系统,验证要求交付的项目如下面表2[3]。
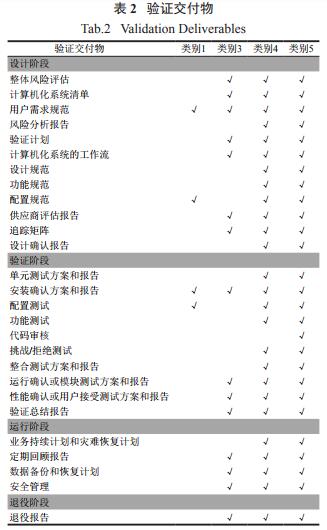
这些验证交付项目必须作为受控的文件管理,并且必须在计算机化系统整个生命周期内维持有效的和现行的。
6)执行验证活动
测试应该核实计算机化系统可以提供与相对应的标准一致的功能。所以在UAT或PQ测试中要核实每一条GMP相关的,且被详细说明在用户需求里的要求。追踪矩阵应该在验证活动中使用,来证明所有GMP相关的要求都已经被测试了,每一条GMP的要求都要至少连接一个测试项目。OQ测试是功能性测试,用来核实功能规格。挑战性测试或是模块测试必须执行,用于测试数据安全性和完整性。
对于GAMP类别为4和5的计算机化系统,挑战性测试必须基于风险分析来决定URS和功能要求规格上哪些内容要被执行挑战性测试。测试至少包括以下项目:
安装(应用软件,反病毒和数据库的安装)备份和相关恢复[7]职责和权限的分离安全(密码复杂程度,字符的数量,锁屏功能)与GMP关键数据相关的所有功能的挑战性测试或拒绝性测试与GMP关键数据相关的元数据的数据完整性(ALCOA)与GMP关键数据相关的审计追踪内容的数据完整性(ALCOA)[8]灾难恢复和业务持续计划公式和计算(正确性的核实和测试)与GMP关键数据相关的报警和警报功能电子签名和电子身份GMP数据的转移(如适用)GMP数据相关的功能的工作流[9]
7)验证报告
验证活动必须被记录在验证报告中。这份报告应该记录验证结果,和所有偏差以及它们的状态。报告提供系统最终验证状态和系统的授权使用。
8)更新计算机化系统清单:最终的验证状态需要记录在计算机化系统清单内。
4结语
计算机系统验证很多人觉得很陌生,或者无从下手。其实简单来说,验证本身就是把在项目初期,把系统适用的数据完整性要求落实到URS中,然后在验证阶段,通过科学的手段核实这些要求都被满足。还有关键的一点是,合理运用质量风险管理的方法,识别必要的风险,将精力和资源集中解决风险较大的点。这样,计算机化系统验证也就能够很好的实施了。
目前国内药厂对计算机化系统验证的理解和执行方法有很多,本文也只是从其中一个角度阐述,希望可以提供一点帮助和启发,使计算机化系统验证可以更广泛,更有效的在行业内实施。

 >
>