加压提取马齿苋抗氧化成分工艺优化
时间:
摘 要:以马齿苋为原料,采用加压提取技术提取抗氧化活性成分。选用 DPPH 自由基清除率和浸膏量作为指标,采用多指标综合评分法考察加压提取过程中提取温度、料液比和提取时间对评价指标的影响,在此基础上采用星点设计-响应面法对提取工艺进行优化。预测得到最佳提取工艺条件:对乙酸乙酯层,提取温度133 ℃,液料比29∶1,提取时间32min;对正丁醇层,提取温度134 ℃,液料比31∶1,提取时间30min。所建立马齿苋抗氧化活性部位提取工艺参数回归模型的相关系数均大于0.9,说明模型与数据拟合度高,可信性好,可用于指导马齿苋抗氧化活性成分提取。
关键词:马齿苋;加压提取;抗氧化成分;响应面法
马齿苋为马齿苋科一年生草本植物的全草,是一种常见的药食两用性植物。近代研究表明[1-2],马齿苋具有抗炎、降血脂、降血糖、抗衰老等药理作用,这与其具有很强的抗氧化活性有 关。如 BEHRA-VAN 等[3]研 究 表 明,马齿苋水提物和乙醇提取物对 H2O2 人 淋 巴 细 胞 DNA 损 伤 有 保 护 作 用;苏 锐等[4]对马齿苋成分进行提取,发现其对羟自由基的清除率 达 68.33%,对超氧阴离子的清除作用达82.26%,对油脂也表现出较强的抗氧化作用。其他学者研究结果[5-6]也提示,马齿苋具有较强的抗氧化活性,有望成为新一代天然抗氧化剂。
为提高马齿苋抗氧活性成分提取效率,更好的发挥马齿苋的临床应用价值,本研究采用加压提取技术提取马齿苋中抗氧化活性成分,并对其提取工艺进行优化,为更好地开发马齿苋中的抗氧化活性成分提供物质支持和实验依据。
1 实验部分
1.1 材料与仪器
马齿苋(PortulacaoleraceaL.),青岛市京城百草厅药房;DPPH(1,1-二苯基-2-苦基肼),美国 Sig-ma公司;乙 酸 乙 酯,天 津 市 广 成 化 学 试 剂 有 限 公司;正丁醇,天津市富宇精细化工有限公司。
紫外可见 分 光 光 度 计,UV-6000型,上 海 元 析仪器有限公司;加压提取装置,实验室自制;旋转蒸发仪,RE-52型,上海亚荣生 化 仪 器 厂;循 环 水 多 用真空泵,河南巩义市峪予华仪器厂。
1.2 马齿苋加压提取
将药材马齿苋用粉碎机粉碎,称取10.0g马齿苋样品,装入药品布袋中,将布袋置于加压提取装置中,根据设定的料液比加入对应量的去离子水,设置加压温度和压力后将加压提取装置进行密封,当温度到达设定温度时开始计时,达到提取时间后关闭加压装置,停止加热并泄压,开罐取出提取液,并趁热过滤。
利用单因素实验法,在提取压力0.5 MPa条件下,考察温度、料液比和时间对提取浸膏得率和抗氧化活性的影响。
1.3 马齿苋提取物不同极性部位的制备
将滤液旋蒸浓缩至50mL,依次用石油醚、乙酸乙酯、正丁醇等体积萃取2次,得到4种不同部位的提取物,各部位提取物置于蒸发皿中挥干溶剂,制成浸膏,备用。
1.4 马齿苋提取物 DPPH 自由基清除率的测定
称取待测物样品适量,用 甲 醇 溶 解,配 成 0.1mg·mL-1的样 品 溶 液,置 于 阴 凉 处 保 存 备 用。取1.0mL样品溶液按常规方法[7]测定抗氧化活性。
1.5 多指标综合评分的计算
各部位综合评分以该部位提取物的浸膏量及其DPPH 自由基清除率为考察指标,根据文献[8]及本实验目的,确定指标的优先顺序为 DPPH 自由基清除率>浸膏 量。将 DPPH 自由基清除率的权重系数设为0.7,浸膏量的权重系数设为0.3,计算各部位综合评分。
2 结果与讨论
2.1 马齿苋抗氧化活性部分确定
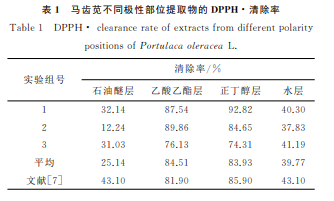
提取温 度130 ℃、料 液 比1∶30、提 取 时 间30min、压力0.5MPa的条件下提 取 得 到 的 马 齿 苋 提取物,分离为不同极 性部位并配置成 0.1 mg· mL-1样品溶液,为与文献[7]作比较,取1.4mL进行 DPPH 自由基清除实验的测定,实验结果见表1。
表 1 显 示 马 齿 苋 不 同 极 性 部 位 提 取 物 对DPPH·清除能力 存 在 一 定 差 别。乙 酸 乙 酯 层 与 正丁醇层提取物对DPPH 自由基有较强的清除效果,而石油醚层与水层提取物的抗氧化活性相对较弱,可见马齿苋中的主要抗氧化活性成分的极性为中等极性和较大极性。根据极性推测,主要抗氧化活性成分可能是马齿苋中含有的中等极性的二萜、生物碱、黄酮苷元等化合物,以及较大极性的含糖基的皂苷类化合物,如甾体皂苷、三萜皂苷和黄酮苷等。马齿苋各个部位提取物对 DPPH·的清除率大小与文献[7]趋势 基 本 一 致。杨 子 娟[9]通 过 DPPH 自 由 基 活 性清除实验和抑制脂质过氧化实验测定也发现,马齿苋主要抗氧化活性成分集中于乙酸乙酯层和正丁醇层。相比较于提取时间长、需多次提取的传统回流提取法[7,9],加压提取法具有提取时间短,提取效率高的优势。而且从目前国外研究报道来看,加压提取技术也有逐渐取代传统提取技术用于多糖[10]、多酚[11]等各类抗氧化成分提取的趋势。
2.2 单因素试验结果
2.2.1 提取温度的影响
在液 料 比 30∶1、提 取 时 间 30 min、压 力 0.5MPa的条件下,考察提取温度对马齿苋提取物的浸膏量和抗氧化活性的影响,结果见表2。
升温可使有效成分扩散速率加快,有利于浸膏产率的提高,但 温 度 过 高,生物质会发生美拉德反应,使提取液颜色 加 深,且可能造成热敏性物 质 被破坏而 使 有 效 成 分 提 取 率 降 低。由 表 2 可 知,乙酸乙酯层和正丁醇层 浸 膏 量 分 别 在110和100 ℃ 时达到最 大,但清除率都呈现出随着 温度升高而增加的趋 势,这可能与温度升高促进 生物质发生美拉德反应有关,根 据 文 献[12]报 道,美 拉 德 反 应产物通常具有较高的抗氧化活 性。根 据 各 层 综 合评分,乙酸乙酯层最佳 提 取 温 度 为110 ℃,正 丁 醇层为130 ℃,若综合考虑 两 部 位,则最佳的提取温度为130 ℃。
2.2.2 料液比的影响
提取温 度 130 ℃、提 取 时 间 30 min、压 力 0.5MPa的条件下,考察不同料液比对提取物浸膏量和抗氧化活性的影响,结果见表3。
表3总 体 趋 势 表 现 为 乙 酸 乙 酯 层 浸 膏 量 少,DPPH·清除率高,而正丁醇层浸膏含量高,清除率低。具体分析,当溶剂倍量从15倍上升至40倍时,乙酸乙酯层和正丁醇层的浸膏量都是先降低然后再升高;但乙酸乙酯层提取物的 DPPH·清除率逐渐降低,而正丁醇层浸膏的 DPPH·清除率却呈逐步升高的趋势,浸膏提取率的变化与 DPPH·清除率的变化并不一致。总体来看,料液比的增加有利于浸膏量的增加,但会影响乙酸乙酯层的抗氧化作用,并且大量溶 剂 的 使 用 造 成 回 收 麻 烦、耗 能 大、浪 费多;而料液比 过 小,会 影 响 正 丁 醇 层 提 取 物 的 清 除率。经综合评分,乙 酸 乙 酯 层 最 适 宜 料 液 比 为1∶ 15,正丁醇层最适宜液料比为30∶1,若综合考虑两部位,则最佳液料比为30∶1。
2.2.3 提取时间的影响
提取温度130 ℃、液料比30∶1、压力0.5 MPa的条件下,考察不同提取时间对提取效果的影响,结果见表4。
适宜的提取时间对提取药材中的有效成分十分重要,时间过短,成分无法浸出完全;而时间过长又会造成资源的浪费,降低生产效率。由表4可知,延长时间,两个部位的浸膏含量都逐渐增加,而 DPPH清除率呈现先升高再降低的趋势,30 min时,两 个部 位 提 取 物 的 清 除 率 皆 较 高,分 别 为 76.77%,49.62%。经综合评分,乙酸乙酯层和正丁醇层的最佳提取时间皆为30min。
2.3 响应面优化
2.3.1 星点试验设计与结果
在单因素试验的基础上,根据中心组合设计原则,选择提取 温 度、液料比和提取时间作为考察因素,每个因 素 设 计 5 水 平,用 代 码 -α,-1,0,1,α (α=1.682)来表示,代码所表示的实际操作物理量见表5。
根据表6试验安排,进行三因素五水平试验,结果如下。综合评分为因变量,其评分越高,表示所在工艺越好。
2.3.2 模型拟合与显著性检验
利用 软 件 Design-Expert8.0.6对 表6的 数 据进行多项式回归分析[13],建立马齿苋抗氧化活性部位提取工艺参数回归模型,得到乙酸乙酯层回归方程公式:综合评分=91.74+5.81×A-0.44×B+1.83×C-2.36×AB+2.30×AC-1.49×BC-4.31×A2 -3.35×B2 -2.48×C2。决 定 系 数 R2为0.9708,校正决定系数R2Adj为0.9445,说明模型与数据拟合度高,可信度好,预测性好。
正丁醇层回归方程公式:综 合 评 分 =85.17+3.17×A+0.77×B+0.57×C-0.079×AB-0.63× AC-0.031×BC-2.45×A2 -1.73×B2 -1.52× C2。决定系数R2 为0.9280,校正决定系数R2Adj为0.8632,说明模型的复相关系数 R 值较高,说明模型与数据拟合度较好。
2.3.3 响应面优化及预测
响应面图可以用于预测和检验变量的响应值,以及确定变量之间的相互关系。温度、液料比和时间对乙酸乙酯层综合评分影响的等高线图和响应面图见图1。
由图1可知,乙酸乙酯层 B(液料比)和 C(提取时间)两 因 素 的 交 互 作 用 较 明 显。利 用 Optimiza-tion功能,预测得到乙酸乙酯层最佳提取工艺条件:提取温度为133℃,液料比为29∶1,提取时间为32min,综合评分为94.71。
温度、液料比和时间对正丁醇层综合评分影响的等高线图和 响 应 面 图 见 图2。由 图2可 知,正 丁醇层提取 A(提取温度)和 C(提取时间)两因素的交互作用较明显。利用 Optimization功 能,预 测 得 到正丁醇层最佳提取工艺条件:提取温度为134℃,液料比为 31∶1,提 取 时 间 为 30 min,综 合 评 分 为86.28。
2.3.4 验证试验
由于提取设备精度限制,对于乙酸乙酯层,设定温度 为 133 ℃,料 液 比 为 29∶1,提 取 时 间 为 32min,进行最佳工艺的验证试验,平行试验3次。实际测得的 综 合 评 分 均 值 为 91.26,和 预 测 值 94.71的偏差为3.64%。
对于正 丁 醇 层,设 定 温 度 为134 ℃,料 液 比 为31∶1,提取时 间 为30 min,平 行 试 验3次,实 际 测得的综 合 评 分 均 值 为86.26,和 预 测 值86.28的 偏差为0.02%。
3 结 论
采用加压溶剂提取法提取马齿苋乙酸乙酯和正丁醇层的抗氧化活性成分,并对其提取工艺进行优化,得到加压提取的最佳提取工艺条件:对乙酸乙酯层,提 取 温 度 133 ℃,液 料 比 29∶1,提 取 时 间 32min;对正丁醇层,提取温度134 ℃,液料比31∶1,提取时间30min。最终实验结果表明:两个活性部位的提取物极性虽然有差别,但提取工艺条件相差不大,这可能与加压溶剂提取技术特有的能够使提取溶剂溶解能力增强、溶解范围增大有关。——本文来源于《青岛科技大学学报(自然科学版)》(双月刊)刊登在:2021年第4期上,论文作者:朱庆书,耿逸婉,肖 薇,郑文迪,赵文英
参 考 文 献
[1]王天宁,刘玉婷,肖凤琴,等.马齿苋化学成分及药理活性的现代研究整理[J].中国实验方剂学杂志,2018,24(6):224-234.WANGTianning,LIU Yuting,XIAOFengqin,etal.ChemicalcompositionandpharmacologicalactivityofPortulacaolerace[J].ChinaJournalofExperimentalTraditionalMedicalFormu-lae,2018,24(6):224-234.
[2]卢新华,关章顺,何军山,等.马齿苋抗氧化有效成分的研究[J].上海中医药大学学报,2004,18(1):56-58.LU Xinhua,GUANZhangshun,HEJunshan,etal.Studyonanti-oxidativeactiveingredientsinportulaca[J].ActaUniversi-tatisTraditionis MedicalisSinensisPharmacologiaequeShang-hai,2004,18(1):56-58.
[3]BEHRAVANJ,MOSAFAF,SOUDMAND N,etal.Protec-tiveeffectsofaqueousandethanolicextractsofPortulacaolera?ceaL.aerialpartson H2O2-inducedDNAdamageinlympho-cytesbycometassay[J].JournalofAcupunctureand MeridianStudies,2011,4(3):193-197.
[4]苏锐,张 红.马齿苋黄酮抗氧化活性研究[J].安 徽 农 业 科 学,2010,38(8):4068-4070.SU Rui,ZHANG Hong.Studyonantioxidantactivityoffla-vonoidsfromPortulacaoleraceaL.[J].JournalofAnhuiAgri-culturalSciences,2010,38(8):4068-4070.
[5]张晓艳.马齿苋活性物质的提取及其抗氧化性研究[D].芜 湖:安徽师范大学,2017.ZHANGXiaoyan.ExtractionandAntioxidantionofActiveSubstancefrompurslane[D].Wuhu:AnhuiNormalUniversity,2017.
[6]李大峰,贾冬英,杜雪,等.马齿苋酚类提取物的抗氧化作用研究[J].中国油脂,2010,35(12):41-43.LIDafeng,JIADongying,DU Xue,etal.Antioxidantactivityofphenolicextractsfrom Portulacaoleraceal [J].China OilsandFats,2010,35(12):41-43.
[7]廖红梅,肖建青,刘锡葵.野生蔬菜马齿苋抗氧化活性[J].食品科技,2010,35(6):214-221.LIAO Hongmei,XIAOJianqing,LIUXikui.Antioxidantactiv-ityofwildediblevegetable-portulacacoleracea[J].FoodScienceandTechnology,2010,35(6):214-221.
[8]王红丽,刘效栓,李季文,等.多指标权重分析与正交设计法优选黄芪女贞方菌质醇沉工艺[J].中国中医药信息杂志,2020,27(10):1-6.WANG Hongli,LIU Xiaoshuan,LIJiwen,etal.Optimizationonalcoholprecipitationtechnologyofmycoplasmfrom HuangqiNvzhen prescription based on orthogonaldesign multi-indexweightanalysis [J].ChineseJournalofInformationonTradi-tionalChineseMedicine,2020,27(10):1-6.
[9]杨子娟.马齿苋的化学成分及抗氧化活性研究[D].长 春:吉 林农业大学,2008.YANGZijuan.StudyonChemicalCompositionandAntioxidantActivityofPortulacaOleracea L.[D].Changchun:JilinAgri-culturalUniversity,2008.
[10]LIUJ,LIYC,LIU W Q,etal.ExtractionofpolysaccharidefromDendrobiumnobileLindl.bysubcriticalwaterextraction[J].ACSOmega,2019(4):20586-20594.[11]LIUXX,LIU H M,YANYY,etal.Structuralcharacteriza-tionandantioxidantactivityofpolysaccharidesextractedfromjujubeusingsubcriticalwater[J].SeparationandPurificationTechnology,2020,236:116217.
[12]胡燕,陈忠杰,李斌.美拉德反应产物的功能特性和安全性研究进展[J].食品工业,2016,37(10):258-262.HU Yan,CHENZhongjie,LIBin.Progressoffunctionalprop-ertiesandsafetyofMaillardreactionproducts[J].FoodIndus-try,2016,37(10):258-262.
[13]彭晓霞,路莎 莎.响应面优化法在中药研究中的应用和发展[J].中国实验方剂学杂志,2011,17(19):296-299.PENG Xiaoxia,LU Sasa.Application ofresponse surfacemethodologyinchinese medicinedevelopment [J].ChineseJournalofExperimentalTraditionalMedicalFormulae,2011,17(19):296-299.

 >
>