不同处理条件对介质阻挡放电低温等离子体杀菌效果及影响 机理研究
时间:
摘要:【目的】研究不同处理条件下介质阻挡放电低温等离子体对单增李斯特菌和肠炎沙门氏菌的杀菌效果,以及抑菌活性物质含量随处理时间的变化。【方法】以单增李斯特菌和肠炎沙门氏菌为对象,研究不同电压、时间及氧气浓度对介质阻挡放电低温等离子体杀菌效果的影响,通过气态活性物质测定管测定 O3 和 NO2 浓度随处理时间的变化,利用荧光强度表征菌液中产生的活性物质浓度,采用荧光分光光度法测定·OH、H2O2 和 1 O2 随处理时间的变化。【结果】采用 70 kV、150 s 或 80 kV、120 s 能够完全杀灭肠炎沙门氏菌,而单增李斯特菌只在 80 kV、120 s 条件下才能被完全杀死。采用 50% O2+50% N2 的混合气体能够在 90 s 内完全杀死细菌。随处理时间的增加,两种菌体细胞内活性氧物质含量呈逐渐增加趋势。【结论】电压、时间及氧气浓度均能显著增强等离子体的杀菌效果,其杀菌作用主要与 H2O2、·OH、1 O2 等活性氧物质的含量有关,其中·OH 和 H2O2 是介质阻挡放电等离子体杀菌的主要物质。
关键词:介质阻挡放电,低温等离子体,活性氧物质,单增李斯特菌,肠炎沙门氏菌,杀菌
非热杀菌是近年来兴起的一种新型杀菌技术。与传统热杀菌技术相比,非热杀菌能够很好地维持食品自身的生物化学特性,保证风味物质及成分不受杀菌过程的干扰而发生损失,对于温度升高引起的食品体系中酶活性的变化能够更加合理地规避,从而在一定程度上延长食品的保质期,达到保鲜杀菌的效果[1–3]。目前常见的非热杀菌方式主要有紫外线杀菌、超高压杀菌、辐照杀菌、高压电场低温等离子体杀菌等,其中高压电场低温等离子体杀菌因其操作简单、设备成本较低、可在常温常压下进行、先包装再杀菌能够很好避免包装过程中产生的二次污染等特点[4–5],该技术目前被广泛用于材料表面改性、空气净化、土壤修复、育种、农产品保鲜等领域[6–7]。其中,在农产品的保鲜防腐方面,国际上已经进行了深入的研究。Ziuzina 等[8]分别用等离子体对西红柿上接种的沙门氏菌、大肠杆菌和李斯特菌处理 10 s、60 s 和 120 s 以后,可以将这 3 种致病菌全部杀灭。经过 5 min 体处理的草莓,在 24 h 内表面菌落数降低了 2 个数量级,且硬度和呼吸速率均不产生明显的变化[9]。Misra 等[5]利用等离子体处理圣女果,其表面菌落数明显降低,颜色和呼吸速率无剧烈变化,货架期得到明显延长。Bursać Kovacěvić 等[10]研究发现经低温等离子体处理后,石榴汁中花青素含量明显升高。介质阻挡放电 (dielectric barrier discharge,DBD)低温等离子体杀菌主要是通过电离空气产生的紫外光子、离子、分子以及各种形式的活性物质与微生物表面接触,对细胞造成氧化损伤,最终导致细菌细胞死亡[11]。影响高压电场低温等离子体杀菌效率的因素主要有处理时间、电压、包装体系内的气体组分、温度、湿度等,通过这些因素的变化,会使体系中产生的臭氧、过氧化氢及羟基自由基等活性氧(reactive oxygen species,ROS)成分的含量发生变化,而这些活性物质正是起到杀菌作用的关键。
近年来,关于低温等离子体在农产品杀菌保鲜方面的研究已经在国外广泛开展,而国内关于这方面的研究相对较少。本实验室采用的低温等离子体杀菌装置为介质阻挡放电 (dielectric barrier discharge,DBD),在 2 个铝电极板之间放置样品,电极与样品之间放入介质板,防止处理过程中产生电弧放电,整个装置如图 1 所示。单增李斯特菌 (Listeria monocytogenes)和肠炎沙门氏菌(Salmonella enteritidis)是生鲜肉品中出现最多的阳性和阴性致病菌,对于这两种致病菌的抑制具有重要的意义。本文主要研究在不同的处理条件(处理时间,处理电压以及包装体系内的气体组成)下,DBD 低温等离子体对单增李斯特菌(革兰氏阳性菌)和肠炎沙门氏菌(革兰氏阴性菌)的杀菌效果,测定处理后部分气态活性成分和液体环境中活性氧物质和活性氮物质含量的变化情况,研究处理过程中活性物质与杀菌率之间相关性关系,初步探究不同活性物质对细菌的杀菌机理,为后续研究提供理论依据。
1 材料和方法
1.1 材料
1.1.1 菌种和试剂: 单增李斯特菌 (Listeria monocytogenes CICC21532),肠炎沙门氏菌(Salmonella enteritidis CICC24119),购自中国工业微生物菌种保藏管理中心;平板计数培养基(PCA),LB 营养肉汤,购自青岛海博生物技术有限公司;Singlet Oxygen Sensor Green,Amplex™ UltraRed Reagent, HPF (Hydroxyl Radical and Peroxynitrite Sensor),辣根过氧化物酶(HRP),购自赛默飞世尔科技(中国)有限公司。
1.1.2 主要仪器:MAP-H360 型复合气调包装机 (配有气体比例检测装置),苏州森瑞保鲜设备有限公司;低温等离子体发生器(配有电压调控箱,可控电压 0–90 kV),美国 Phoenix 公司;SJ-CJ-1D 型超净工作台,苏洁净化仪器设备有限公司; SMIC 型电热灭菌锅,上海申安医用仪器厂;电热恒温培养箱,上海一恒科学仪器有限公司; AUY120 型电子天平,UV-2600 紫外-可见分光光度计,日本岛津公司;Multiskan MK3 酶标仪,美国赛默飞世尔科技(中国)有限公司。 1.2 菌悬浮液的制备从–40 °C 冰箱中取出传代培养 3 次的菌种保藏管,加入到 100 mL 的 LB 营养肉汤中,37 °C、 200 r/min培养18 h,取培养好的菌液离心(7000g, 4 °C,7 min),去上清,加入 0.85%生理盐水清洗 2–3 次,调节菌液浓度为 108 CFU/mL,保存备用。
1.3 不同处理条件下杀菌效率的研究
将菌悬液混匀,加入到灭菌后的 96 孔板中备用。
1.3.1 不同处理时间及电压对杀菌效率的影响:对 96 孔板进行包装,气氛条件为空气。选取不同处理电压和不同处理时间对两种菌悬液处理,随后立刻打开包装盒进行微生物计数实验。采用平板涂布法进行菌落总数测定,以未做处理的菌悬液作为空白对照。将涂布好的培养基置于 37 °C 恒温培养箱中培养 3 d,每天定时进行菌落计数。每个样品做 3 次平行。
1.3.2 不同氧气浓度对杀菌效率的影响:选取处理电压为 75 kV,不同氧气含量点对菌悬液进行等离子体处理,随后立刻打开包装盒进行微生物计数实验,计数方法与 1.3.1 相同。
1.4 等离子处理产生的活性成分研究选取处理时间的变化对杀菌效果影响,处理电压为 75 kV,探究不同处理时间产生的活性氧物质的变化情况,研究活性氧物质与杀菌率之间的相关性。
1.4.1 细胞内整体 ROS 含量测定:调整菌液浓度至 106 –107 CFU/mL,经等离子体处理后,加入 H2DCFDA 染料至终浓度为 1 mmol/L,37 °C、5% CO2 培养箱静置 0.5 h,PBS 溶液洗涤细胞 3 次,去除未进入细胞内的 H2DCF-DA。在激发光/发射光为 485/528 nm 波长条件下读取数值。空白对照组(CK 组)为未处理细胞+H2DCF-DA。每个样品做 3 次平行。
1.4.2 不同时间条件下产生的气态活性氧(氮)物质含量研究:等离子体处理后,气体环境中主要的活性成分是 O3 和 NO2。因此,主要检测这两种成分。O3及 NO2浓度测量使用 drager 臭氧检测器管 [德尔格(中国)安全设备有限公司]测量密封包装内的 O3以及 NO2浓度[12]。抽取 10 mL 处理后包装盒内气体,适当稀释后经检测管,通过检测管内颜色变化对应管壁上的刻度,读取相应数值,最后乘稀释倍数,得到最终包装盒内 O3及 NO2浓度。
1.4.3 不同处理时间菌液中产生的活性氧物质浓度变化研究:选取 3 种最主要的活性氧物质进行测定,分别是·OH、H2O2 和 1 O2。1 O2 测定:将一支 Singlet Oxygen Sensor Green 试剂与 33 μL 甲醇混合,加入 33 mL PBS 溶液,配置成 5 mol/L 的工作储备液,避光保存待用。经等离子体处理的菌液加入 Singlet Oxygen Sensor Green 工作液在 37 °C 下避光孵化 15 min,在激发光/发射光为 485/530 nm 条件下测定荧光强度。H2O2 测定:将 1 瓶 Amplex™ UltraRed Reagent 与 340 μL DMSO 混合,记为Ⅰ,再将辣根过氧化物酶用 PB 配成 1 U/mL 的溶液,记为Ⅱ,取 50 μLⅠ和 100 μL Ⅱ混合后加入 50 mmol/L 的 PBS (pH 7.4) 4.85 mL 一起混合成工作液避光保存待用。经等离子体处理菌液加入混合工作液后在 37 °C 下避光孵化 15 min,在激发光/发射光为 530/590 nm 条件下测定荧光强度。·OH 测定:30 μL HPF (hydroxyl radical and peroxynitrite sensor)和 30 mL PBS 混合。未处理的菌液与工作液 1︰1 混合,在 37 °C 孵化 20 min,离心去除多余的荧光染色剂,加入相同体积的 PBS 溶液,经等离子体处理后,激发光/发射光为 490/515 nm 条件下测定荧光强度。以不加菌液的作为 CK 组。
1.5 数据分析
本文相关实验结果均采用平行测定 3 次所取的平均值。采用 Oringin 8.0 绘图。显著性分析采用 SAS 分析软件中的单因素方差分析。
2 结果和分析
2.1 处理时间和电压对杀菌效率的影响
研究不同处理电压及时间对单增李斯特菌 (革兰氏阳性菌,G+ )和肠炎沙门氏菌(革兰氏阴性菌,G– )杀菌效果。初始菌落数为 8 log 时,等离子体处理电压越高、处理时间越长,其杀菌率越高(图 2 和图 3)。等离子体处理 80 kV、120 s 时能够完全杀灭单增李斯特菌(图 2)。而肠炎沙门氏菌在处理电压 70 kV 时,处理 150 s 或 80 kV、120 s 时可完全杀死细菌。
2.2 不同氧气浓度对杀菌效率的影响
当使用不同的 O2和 N2比例作为介质气体处理菌悬液,如图 4 和图 5 所示。氧气含量在 20%以上时,随处理时间增加,菌落数逐渐降低。当氧气浓度在 20%、30%、40%和 50%时,单增李斯特菌分别在 150、120、120、90 s 以内达到完全杀灭的效果。当氧气浓度在 20%、30%、40%和 50%时,肠炎沙门氏菌分别在 150、90、90、90 s 以内达到完全杀灭的效果。且氧气浓度越高,杀菌速率越快。对比图 2 和图 3,当利用相同的处理条件处理两种菌悬液时,单增李斯特菌的存活数量明显多于肠炎沙门氏菌。
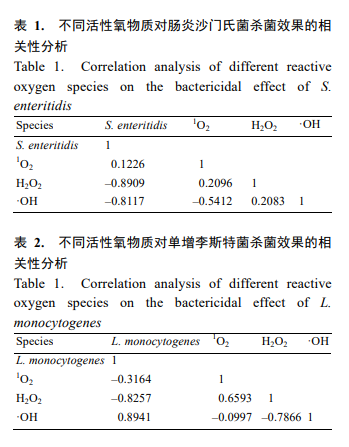
等离子体杀菌主要是通过产生各种 ROS 对菌体细胞形成氧化作用,并最终导致其死亡的过程。活性氧和活性氮成分中的一些物质,如 H2O2,由于其具有较高的氧化作用,被认为是主要的杀菌成分。其中,含氧活性成分在杀菌过程中起主要作用[13]。氧气含量较低时,生成的含氧活性成分(O3、NO2、1 O2、 H2O2、·OH 等)含量低,杀菌效果不显著。当氧气含量达到一定浓度时,能够激发产生的含氧活性物质是有限的,即达到饱和状态,此时如果处理条件不变,即使提高氧气浓度,也不会产生显著的变化。
2.3 细胞内整体 ROS 含量随处理时间的变化情况
经等离子体处理的菌悬液,细胞内 ROS 水平明显升高,且随着处理时间增加,两种菌体内的 ROS 水平均逐渐升高。对于同一处理时间,单增李斯特菌菌体细胞内 ROS 水平明显高于肠炎沙门氏菌。肠炎沙门氏菌在 60 s 时荧光强度产生明显的上升,说明菌体内 ROS 水平产生了明显的增加,随后缓慢升高,趋于平稳。单增李斯特菌在 30 s 时荧光强度就处于较高水平,且之后随处理时间增加,荧光强度缓慢增加(图 6)。这是因为对于革兰氏阴性菌主要是通过 ROS 破坏外部组分,而对于革兰氏阳性菌,主要是通过 ROS 进入细胞内,与细胞内的大分子物质结合,造成核酸和蛋白质的氧化损伤[14]。
2.4 O3和 NO2含量随处理时间的变化
随处理时间的增加,O3 和 NO2 浓度逐渐增加,且 O3 浓度显著高于 NO2。O3 浓度在 0 s 到 90 s 时增长率逐渐变缓,90 s 到 120 s 时增长率变大,在 120 s 到 150 s 时,O3 浓度出现缓慢下降,可能是由于在较高浓度的 O3 条件下,部分 O3 会和水反应生成强氧化性的 HO2。NO2 在整个实验范围内,几乎呈线性增长。从图 7 可知,O3 浓度在任何时间点都显著高于 NO2,相差一个数量级,说明 O3 是整个处理过程中产生的主要活性物质,并且从氧气浓度对杀菌效率关系中也可以看出,O3 在细菌抑制过程中起到至关重要的作用[15]。NO2 可以和 H2O 反应,最终形成 NO2 – 和 NO3 – ,使溶液酸化,参与杀菌反应。
2.5 菌液中 ROS 含量随处理时间的变化
单线态氧含量变化如图 8 所示,利用荧光强度高低来间接表示含量变化。所有实验组 1 O2 水平呈现出先增加后降低,最后达到稳定的趋势。
任意处理时间点,CK 组 1 O2 含量均高于两种菌,当处理时间为 120 s 和 150 s 时,CK 组和菌液处理组含量基本相同,且维持在同一水平线上。1 O2 半衰期较短,不易与菌体发生充分的反应,因此在短时处理时,与 CK 组相比,荧光强度有所降低,说明短时处理,1 O2 可以起到一定的作用,当处理时间延长时,1 O2不再是主要的活性抑菌物质[16],且 1 O2 只能与菌体内的少数物质发生反应。
H2O2 含量变化如图 9 所示,随处理时间增加,两种细菌内部荧光强度均出现先增加后稳定的趋势,在前 120 s 处理时间范围内,单增李斯特菌菌体内 H2O2 的含量显著低于 CK 组和肠炎沙门氏菌,这是由于在单增李斯特菌体内含有大量的过氧化氢酶,能够很好地降解 H2O2 达到保护菌体的作用。当杀菌时间达到 150 s 时,两种菌液所含有的 H2O2 含量与空白对照组基本一致,这是由于高电压长时间处理,造成了菌体内酶活力降低,无法对产生的 H2O2 有效降解[17–18]。此外,当细胞内存在 Cu+ /Fe2+时,可以与 H2O2 发生芬顿反应生成·OH[19]。NO2 – 也可以与 H2O2 反应生成 ONOOH, ONOOH 或 ONOO– 均能够氧化脂质和蛋白质[20]。 H2O2 转化后的这些物质均能够对菌体造成不同程度的破坏,最终导致菌体死亡。
OH 含量变化如图 10 所示,在整个处理过程中,单增李斯特菌和肠炎沙门氏菌的荧光强度显著低于 CK 组,并且随着时间增加,两种菌内的·OH 含量无显著变化。·OH 是一种氧化性极强的自由基,可以与生物体内的任何物质发生快速反应从而被消耗,被氧化的生物体蛋白质等发生变形导致生物功能降低或失活,达到杀灭微生物的效果。·OH 具有很高的氧化电势,能够破坏微生物的通透性屏障,穿过细胞外层结构,进入细胞内对蛋白质、酶以及核酸造成破坏,并最终导致细菌体死亡[21–23]。 ——论文作者:马良军 1 ,王佳媚 1,2,黄明明 1 ,章建浩 1*,严文静 1*
本文来源于:《微生物学报》是以微生物学基础研究和应用基础研究以及高技术创新为主的综合性学术刊物。他反映我国微生物学研究领域中最新成果,促进国内外学术交流,为我国的经济建设服务。主要报道我国普通微生物学、工业、农业、医学、兽医微生物学,病毒学,免疫学和微生物学有关的生物工程等方面的研究论文、研究简报和小型综述等。

 >
>