超声波及其辅助灭菌技术在食品微生物安全控制中的应用
时间:
摘要 超声波作为一种有效的辅助杀菌技术,已成功用于多种液体食品中微生物的控制,在食品加工领域具有广阔的应用前景。 本文阐述了超声波灭菌机制,认为超声波产生的空化效应是导致微生物失活的主要原因。 此外,讨论了影响超声波杀菌效果的主要因素,并综述近年来超声波辅助灭菌技术(如热、压力、臭氧、脉冲电场、紫外线及抗菌剂等)的研究情况,为超声波及其辅助灭菌技术在食品微生物安全控制中的应用提供理论基础。
关键词 超声波; 灭菌机制; 超声波辅助杀菌技术; 食品安全
目前食源性疾病是全世界范围内最突出的公共卫生问题。 据世界卫生组织估计,全球每年约有 220 万人死于食源性或水源性腹泻。 除此之外,全球每年约 1/4 食品的损失由微生物活动引起。 这不仅造成了巨大的经济损失, 而且对公共健康构成威胁[1] 。 食品工业中通常采用高温加热的传统灭菌方法杀灭微生物。 然而,高温处理不仅会破坏食品中的热敏性成分,影响食品的色泽和风味,还会降低食品营养价值。 非热杀菌技术如脉冲磁场(PEF)、高压、等离子体及超声波等成为近年来食品工业关注的焦点。 它不仅能避免传统高温处理的缺陷,而且具有均匀度高、能耗低以及绿色环保等优点,是一种更安全、有效的灭菌方法[2] 。
超声波灭菌作为一种有效的辅助杀菌手段,已成功应用在饮用水消毒和废水处理方面, 且在如橙汁、 酱油和啤酒等液体食品灭菌中的应用也有较多研究[3] 。 然而,超声波单独杀菌的杀菌能力及作用范围有限, 尤其针对抗性较强的芽孢及真菌类微生物,杀菌作用效果一般。 另外,在实际应用中, 长时间使用高强度的超声波单独处理不仅有较大的能耗及设备耗损, 对食品品质也有较大影响。 当前迫切需要建立一种绿色经济并且安全高效的灭菌方法。 大量文献表明超声波协同其它杀菌手段,如热[4-5] 、压力[6] 、紫外线[7-8] 、脉冲电场[9] 及抗菌剂[10] 等,可有效缩短处理时间,提高杀菌效果, 且在杀灭微生物的同时能够最大限度地保护食品中的有效成分(如牛奶中酪蛋白及总蛋白)及钝化果蔬汁中的相关酶类, 在保证食品安全以及延长其货架期方面的作用不容忽视, 具有广阔的发展前景。
1 超声波及其杀菌机制
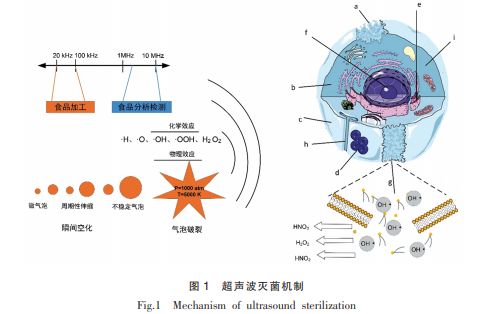
超声波是指频率为 20 kHz 以上的声波,属于弹性机械波, 通常使用频段范围为 20 kHz~10 MHz。 按照频率可分为 2 大类[11] :一种是频率范围在 2~10 MHz 的高频超声波, 通常应用于食品分析检测领域(图 1),为食品组成、质构及流变学性质提供数据;另一种是频率处于 20~100 kHz 范围的低频超声波(图 1),因具有较高的能量被称为功率超声波,在乳化、干燥、解冻及食品功能改性等食品加工领域具有广泛应用, 尤其在非热杀菌方面备受关注。
超声波的杀菌能力归因于其产生的空化作用。 频率在 2.5 MHz 以下的超声波在液体介质中传播时会产生纵波,形成交替的压缩和膨胀区,在这些区域介质中压力的改变可引起空穴效应并激活微小泡核。 激活的空化泡核经振荡、生长、收缩及崩溃等一系列动力学过程聚集声场能量并瞬间释放,在狭小空间内产生瞬间局部高温(约 5 000 K)和高压(约 1 000 atm),温度变化率可达 109 K/ s,并伴有强烈冲击波[12] (图 1)。 超声波在微生物细胞壁附近及细胞内产生的空化效应可引起细胞壁变薄甚至裂解, 从而导致微生物细胞抵抗外界胁迫能力下降。 在超声波能量的压缩和稀疏循环条件下, 微生物细胞因受到周期性变化的压力而产生共振,双层磷脂分子振动频率和振幅加大,导致细胞膜穿孔甚至破裂,胞内基质泄露,从而加快菌体死亡[13] (图 1a,1b,1c,1d,1i)。 空化作用形成的微射流可扰动并改变胞内酶分子构象, 降低甚至使酶失活(图 1e),从而抑制微生物相关代谢通路,其具体通路尚不明确。 另外,膜内的流体静压力可诱导细胞核机械破裂致使核内 DNA 释放(图 1f),这对微生物失活具有重要作用。 空化泡在瞬间破裂时产生的高温高压使其周围的水分子裂解产生·H、·O 和·OH 自由基,进而生成·OOH 和 H2O2 等高反应活性微粒,促进硝酸、亚硝酸和 H2O2 等胞内物质释放(图 1g)及单电子转移[13-14] ,进而影响溶液的酸碱度,破坏细菌生长的外界环境,降低细胞结构的稳定性(图 1h)。 另外,自由基的大量产生会氧化细胞脂膜结构,扰乱 ATP 产生酶的活力,且产生的·OH 自由基能够与核内 DNA 链中磷酸二酯键发生化学反应,导致微生物双链 DNA 因磷酸酯键分离而断裂,从而引起微生物失活[15] 。
2 影响超声波灭菌效果的因素
超声波在不同条件下单独作用时, 杀灭微生物的效果存在差异。 影响超声波灭菌效果的主要因素包括微生物特性、超声作用参数(振幅、频率及时间)以及环境介质。
2.1 微生物特性
所有微生物对超声波都有一定的抗性, 抗性因微生物的种类、形状及大小而存在差异。
2.1.1 细菌 近年来, 关于超声灭菌的研究报道虽有很多, 但对超声灭菌效率与细菌的特性之间的关系仍存在较大分歧。 有报道[16] 指出革兰氏阴性菌比革兰氏阳性菌更容易被高强度超声波杀灭。方祥等[17] 研究发现相同超声波(33 kHz)对大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella typhimurium)两种致病菌的致死率明显高于金黄色葡萄球菌(Staphylococcus aureus)。 相似地,Garud 等[18] 发现声热协同处理甘蔗汁中的大肠杆菌和蜡样芽孢杆菌(Bacillus cereus)相同时间后,蜡样芽孢杆菌的致死量仅为大肠杆菌的一半。 上述文献认为造成致死率差异的主要原因可能与细胞壁成分和结构差异有关。 革兰氏阴性杆菌,如大肠杆菌和沙门氏菌,其细胞壁较薄,主要由双层磷脂分子和蛋白质组成的外膜(厚度为 7~8 nm)及肽聚糖薄层(厚度为 2~7 nm)构成,经超声波处理后的细胞壁外膜和细胞膜均容易被撕裂而产生孔洞,导致胞内基质流出,加速细胞死亡。 而革兰氏阳性球菌,如金黄色葡萄球菌,其细胞壁为一层刚性较强的铰链立体网状结构的肽聚糖层, 较厚且有磷壁酸分子对其进行加固,对细胞膜起到保护作用,超声波处理时不易破坏其结构的完整性, 所以菌体抗逆性较强,死亡率较低[19] 。 然而也有文献[11,20] 认为超声波引起的微生物失活与细菌革兰氏状态无显著关系,而与壁膜厚度和弹性程度有关。
2.1.2 芽孢 芽孢是某些细菌(如芽孢杆菌、梭状芽孢杆菌及少数球菌等) 为适应不良环境而在细胞内形成的圆形或椭圆形抗逆性强的休眠体,其营养体细胞对超声波较敏感, 而单独采用超声波对芽孢致失活作用微弱。 影响芽孢抗性的主要因素包括营养体的最适生长温度及芽孢生成温度(最适生长温度及芽孢生成温度越高,芽孢的抗性越强)、核内较低的水分含量、核内较高的 2、6-二磷酸吡啶(DPA)及其金属螯合物(其中绝大多数与钙离子螯合)和对核内 DNA 起保护作用的酸性可溶性蛋白(α/β 型)[21] 。 基于其较高的抗性,大多数研究采用超声波与其它灭菌手段相结合的技术来提高芽孢的失活率[22-23] 。 在超声波辅助热处理失活枯草芽孢杆菌芽孢[24] 、蜡样芽孢杆菌芽孢[22] 及地衣芽孢杆菌芽孢[25] 过程中,超声波处理往往会引起芽孢一些特征的改变,如膨胀、表面破损及生长刺激等,从而降低芽孢的热抗性。 也有报道[26] 指出, 经强度为 15~36 W/mL 超声处理的梭状芽孢杆菌(Clostridium spp.)芽孢其热抗性并没有发生改变, 说明超声波失活芽孢过程与产芽孢菌体的种类也存在相关性。 另外,有报道[27] 指出,超声波协同其它手段(如高压)可促使芽孢萌发形成抗性较弱的营养体,从而提高芽孢的失活率。
2.1.3 真菌 真菌(霉菌和酵母)对超声波的抗性虽不及孢子,但相较细菌,其抗性仍较强[28] 。 一般认为, 霉菌对超声波的敏感性比酵母菌更强。 例如,Coronel 等[29] 研究发现黄曲霉经超声波辅助热处 理 2 min, 其 致 死 量 就 可 达 2 个 数 量 级 , 而 Sánchez-Rubio 等[30] 采用声热结合的方法需处理石榴汁中接种的啤酒酵母 30 min, 才可降低 2.52 个数量级。 另外,采后果蔬易受镰胞菌属(Fusarium)、交链孢属(Alternaria)及茎点霉属(Phoma)等霉菌污染, 它们产生的毒素会对消费者构成健康威胁。 Cao 等[31] 研究表明,借助超声波(40 kHz)可有效减少采后果蔬因霉菌污染而造成的损失。
目前来看, 超声波失活微生物与其特性之间的关系仍不明确。 然而,一般认为,细菌芽孢对超声波的抗性比营养体强,有氧菌比厌氧菌强,超声波杀灭杆状菌比球菌快,杀灭大杆菌比小杆菌快。另外, 超声波对微生物的失活能力还与其表面疏水性有关。 由于超声波产生的空化泡表面为疏水性表面,微生物细胞表面疏水性越强,对空化泡的吸引能力就越强,从而被损伤程度越深[24] 。
2.2 超声波作用参数
影响灭菌效果的主要超声作用参数包括超声波的频率、振幅、处理温度及作用时间。 超声波灭菌效果随超声波能量的增加而增加。 研究表明,超声波灭菌效果与其作用时间呈正相关, 即作用时间越长,灭菌效率就越高。 而考虑到能耗和对介质中热敏性成分的影响, 超声波作用时间并非越长越好, 因此超声波作用时间的选择需要特别注意[28] 。
超声波作用于液体介质, 其空化强度会随着声强的增大而增大,直至趋于饱和值。 此时继续增加声强, 空化强度会因产生大量无效的气泡而降低,从而降低杀菌效果。 一般情况下,在 1~61 W/ cm2 的范围内的超声波声强可达到较为理想的杀菌效果。 而空化强度会随着超声频率的升高而降低。 研究表明, 目前用于杀菌的超声频率多选择 20~50 kHz[32] 。 另外,有报道指出,一定强度的超声可以诱导细菌进入活的非可培养(VBNC)状态[15,33] ,处于该种状态的微生物仍具有活性, 放置过程中会复苏。 因此,应注重筛选最佳杀菌工艺条件,避免处于 VBNC 状态的微生物威胁公共卫生和食品安全。
选择处理温度是实现超声波杀菌效果的一个重要环节。 低温辅助超声波杀菌已被证实具有较好的杀菌效果[4] 。 然而,在较高的处理温度下,液体介质中蒸汽压升高,黏度降低,从而导致超声波产生的空化泡在瞬间爆破时释放能量减少, 杀菌效果降低[34] 。
2.3 环境介质
超声波杀菌效果与环境介质 (如溶液的 pH值、组成及黏度等)存在一定联系。 Sánchez-Rubio 等[30] 采用超声波辅助热对橙汁和石榴汁中的啤酒酵母处理 30 min 后,其致死量分别为 2.81 和 2.52 个数量级, 分析认为介质 pH 值的高低是造成杀菌效果产生差异的主要原因。 相似地,Lãpez-Malo 等[35] 发现当 pH 值不变而水活度增加时,超声波辅助热对指状青霉的杀菌效率显著增加。
总的来说, 超声波灭菌效率除与超声波的频率和强度有关外, 还依赖于微生物种类及本身结构特性[36] ,至于超声灭活微生物与微生物特性之间的关系还有待明确, 因此应根据具体的需求和条件,综合不同特性微生物种类,选取最佳的杀菌工艺参数,从而实现短时高效的杀菌效果。
3 超声波辅助杀菌技术在食品安全控制中的研究进展
超声波单独处理时,容易作用而杀菌不彻底,若与其它杀菌手段结合, 利用它们之间的协同效应不仅能显著提高杀菌效果,增强杀菌均一性,还可减少风味损失,降低能源消耗,因此在食品加工领域具有很大的应用潜力[15] 。 表 1 为近十几年来超声波辅助热处理、压力、渗透压、紫外、脉冲电场、等离子体及抗菌剂的研究进展。
3.1 超声波辅助热杀菌
超声波辅助热杀菌有不同的组合方式, 如先超声预处理后热处理, 先热预处理后超声处理以及热与超声同时处理。 Evelyn 等[26] 采用超声波(24 kHz,0.33 W/g)辅助热(75 ℃)同时处理 60 min,对牛肉酱中接种的梭状芽胞杆菌芽孢 (NZRM 898 和 NZRM 2621)灭活量不足 1.5 lg。 然而,在热处理之前进行短时超声处理可将牛肉酱中接种的芽孢的失活率(D95℃)由原来单独热处理的 20.2 min 降低到 9.8 min。 另外,施红英等[49] 研究发现声热结合(52 ℃,190,380,570 W)分别处理 40,30,30 min 即可使几乎全部的鼠伤寒沙门氏菌失活。 并发现在较低温度(32~47 ℃)下超声波和热无协同效应,杀菌效果主要取决于超声波作用;而在致死温度(52 ℃)下二者协同杀菌,显著提高杀菌速率。
Wordon 等[50] 认为超声波辅助热灭菌过程中超声波预处理会在细胞内造成非致死性损伤, 从而加快热处理对微生物细胞的致死率。 另外,有报道[28] 指出声热复合同时杀菌过程中热处理造成的微生物细胞物理性损伤可致使其对空化效应更敏感。 然而,温度过高会降低超声波空化效应[35] 。 综上可知, 充分把握超声波辅助热杀菌过程中二者的协同关系对减少微生物负载, 节约成本和能耗具有关键性作用。
3.2 超声波辅助压力灭菌
超 声 波 与 压 力 结 合 可 增 强 微 生 物 杀 灭 效果,主要原因在于自由基产量的增 加[51] 和 空 化泡 爆 破强度增大[52] 。 多数研究表明压力超声波(Manosonication) 的杀菌模型为一级动力学模型,并用 D 值来表示杀菌效果。 Manas 等[6] 报道超声波(20 kHz)结合的压力从 0 升至 200 kPa 时,柠檬酸磷酸缓冲液中李斯特菌 (Listeria) 的 D 值由 5.7 min 降到 2.5 min。 然而,Raso 等[53] 指出当超声波(20 kHz) 结合的压力从 300 kPa 增加至 600 kPa, D 值由 0.28 min 仅降到 0.20 min,几乎没有统计学差异。 因此,为达到最大的协同效果,确定最佳的压力水平至关重要。 超出最佳压力水平,超声波会因无法克服超高压与液体分子之间的凝聚力[54] ,而导致空化作用降低,进而降低杀菌效果。
相关知识推荐:论文返修延期申请如何写
为获得更好的杀菌效果, 多数研究倾向于采用压热声处理 (Manthermosonication), 即将超声波、压力及热结合,这种处理产生的杀菌效应可归因于热和压力超声波两种机制[53] 。 Alvarez 等[55] 发现采用超声波(20 kHz)结合压力(175 kPa)、热(35 ℃) 可将柠檬酸磷酸缓冲液中接种的沙门氏菌(Salmonella)的 D 值降低至 1.71 min;若将温度升至 67 ℃,D 值可降至 0.02 min。 该协同效应同样发生在 Lee 等[27] 将超声波(20 kHz)、压强(100 kPa)、热(59 ℃)结合对苹果汁中大肠杆菌进行杀灭的过程中(表 1)。 另外,压热声结合可用于芽孢失活,如 Raso 等[56] 采用压热声(20 kHz,500 kPa,70 ℃)协同对枯草芽孢杆菌芽孢处理 12 min, 可将芽孢数量降低 99%。 现有文献表明[5] ,压热声杀菌效果依赖于热处理的温度。 在较低温度下(<50 ℃),压热声结合灭活微生物时, 其中热处理所发挥的作用几乎可以忽略。 而在较高温度下,热处理和声压结合处理之间的协同效应则是导致微生物失活的主要原因。 因此,在压热声处理过程中,确定协同失活微生物的最佳温度是优化该种灭菌技术的关键所在。
3.3 超声波辅助紫外杀菌
紫外线(UV)具有一定的杀菌效率,且绿色环保,然而鉴于其穿透能力有限,可将其与超声协同灭菌。 Naddeo 等[57] 采用 UV(150 W)单独处理废水中的大肠杆菌 10 min, 所失活的数量并不能满足相关法规要求(10 CFU/100 mL)。 然而,如果在相同条件下协同超声波(1 400 W)可将微生物负载降至 2 CFU/100 mL。 相似地,Char 等[58] 采用先超声波 (20 kHz,10 min) 后 UV (100 W,257.7 nm,10 min) 的方式, 可将橙汁中的大肠杆菌降至 1.86 lg;而单独超声(20 kHz)达到相同的失活量则需 20 min。 然而,相同条件下超声波辅助 UV 同时处理 20 min,比原来多失活 1.6 lg 的菌体。 Tremarin 等[7] 在采用超声波协同 UV 对苹果汁中脂环酸芽孢杆菌芽孢杀灭处理时也发现相似的现象。 超声波辅助 UV 实现高效杀菌的原因在于超声波在液体介质中产生大量空化气泡, 从而提高了紫外线的透光率和杀菌率。 然而,二者协同杀菌的具体机制仍不明确,还需进一步探索。
3.4 超声辅助脉冲电场杀菌
脉冲电场(PEF)同超声波技术一样,是一种非热杀菌技术, 其作用机理主要是脉冲电场在细胞膜上产生“电穿孔”效应致使细胞膜破裂,导致细胞内基质外泄从而引起菌体失活。 Palgan 等[9] 采用 MST(20 kHz,200 kPa,52 ℃)和 PEF(34 kV/cm, 32 μs)复合杀灭冰沙中的李斯特属时,发现短时间内可将菌数减少 4~5 个数量级,且先 MST 处理后 PEF 处 理 的 杀 菌 效 率 要 高 于 先 PEF 处 理 后 MST 处理(表 2)。 相似地,Huang 等[42] 发现在 PEF (30 μs,5.67 kV/mm)前采用超声波(20 kHz,55 ℃)处理可明显提高对全蛋液中肠炎沙门氏菌的杀菌效率(表 1)。 总体来看,超声波和脉冲电场协同处理顺序在杀菌过程中发挥重要作用, 超声波预处理可改变细胞膜特性从而与 PEF 发挥协同效应。
3.5 超声波辅助臭氧杀菌
超声波辅助臭氧杀菌(Sonozonation)已作为一种杀菌手段用于饮用水的净化处理。 沈其动[59] 指出超声波辅助臭氧处理 20 min, 相比单独的超声波处理,杀菌率可提高 12.02 个百分点,其原因在于超声可促使臭氧在水溶液中发生化学反应,增加溶液 pH 值和双氧水浓度,从而提高杀菌效率。另外也有研究[60] 认为超声能使臭氧气泡破碎成为微气泡, 而这些微气泡极大地提高了臭氧在溶液中的溶解度,从而使细菌迅速被氧化杀灭。
3.6 超声波辅助抗菌剂杀菌
超声辅助处理可通过加快抗菌剂的扩散速度而提高灭菌效果,从而保证食品安全和质量。 关于超声波辅助加快分子在食品介质中大规模转移的现象有几种解释, 包括在固体表面附近产生的不对称的空化现象, 并在垂直固体表面的方向上产生微射流。 这些微射流通过扰乱超声波处理表面的边界层来加快分子在食品介质中的大规模转移。 此种微射流在盐水注入肉类样品中已经得到使用,以此增加水分和盐溶液的含量[10] 。 超声辅助处理技术的发展可以提高生物活性化合物的功效,与水辅助表面清洗相比,这种技术所需化合物的浓度要低得多。
二氧化氯(ClO2)在国际上被公认为是安全、无毒的绿色消毒剂, 因具有较强的氧化性也常被用作杀菌剂。 Chen 等[61] 采 用 超 声 波 (100 W,10 min)辅助 ClO2(40 mg/L,10 min)处理比二者单独处理具有更高的杀菌效率, 且经超声波辅助 ClO2 处理的李子无化学残留, 货架期相比对照组可延长 20 d, 因此被认为是一种具有广阔前景的李子采后处理方法。 相似地,Aday 等[62] 研究发现,采用超声波(30 W)辅助 ClO2(6 mg/L)处理相比各自单独处理能更有效的阻止霉菌生长, 而且对草莓的质量如 pH、总可溶性固形粒、电导率及风味的影响较小,可有效延长草莓的货架期。
过 氧 乙 酸 (PAA) 可 以 被 看 作 是 过 乙 酸(CH3CO3H)和双氧水的结合,具有较强的氧化性,在食品工业中常用其来清洗水果和蔬菜。 Aday 等[62] 研究发现超声辅助 PAA(200 mg/L 对接种在黄瓜中的阪崎肠杆菌处理 60 min, 致死率比二者单独处理时至少提高了 1.63 lg, 且超声波协同 PAA 处理对黄瓜的颜色、 湿度及质地等品质性能的影响较小。
4 结论及展望
超声波因其独特的声化学效应而在杀灭微生物保证食品安全方面带来了方法学的创新, 对传统杀菌技术形成了有益的补充。 国内外虽有大量研究证明超声波辅助其它灭菌技术具有良好的灭菌效果, 但将其规模化应用到实际微生物控制保证食品安全当中仍面临挑战。
充分了解超声波与其它灭菌手段协同过程中的“空化效应”对研究微生物失活机制和不同技术间协同效应的应用具有推动作用。 就目前超声波辅助杀菌机制而言, 大部分研究均基于细胞表观的机械性损伤电镜和物化特性分析, 而从分子水平,如基因表达及蛋白代谢通路方面,阐述微生物失活的相关研究较少, 致使超声协同杀菌的相关分子生物学机理尚不清楚, 从而无法实现超声波辅助技术杀菌效应得到更进一步的积极利用。 关于超声波辅助其它杀菌技术的相关研究虽有不少, 但仍需明确微生物特性与协同灭菌手段之间关系。 另外,超声波辅助其它技术杀菌过程中最终导致的潜在安全性问题的研究还相当欠缺, 距完全代替传统灭菌方法仍有一定距离。 因此未来超声波协同杀菌技术的研究应注重多学科和多种技术的相互交叉渗透, 明确杀菌过程中的关键因素及作用位点, 通过开发新型的杀菌设备与优化最佳工艺参数来保证食品安全, 这对我国推动食品科学发展及食品安全控制都具有重大意义。——论文作者:樊丽华 1 侯福荣 1 马晓彬 1 邹明明 1 郭鸣鸣 1 丁 甜 1 刘东红 1,2*
参 考 文 献
[1] 陆姣, 王晓莉, 吴林海. 国内外食源性疾病防控的研 究 进 展[J]. 中 华 疾 病 控 制 杂 志 , 2017, 21 (2): 196-199.
[2] SANGO D M, ABELA D, MCELHATTON A, et al. Assisted ultrasound applications for the production of safe foods[J]. Journal of Applied Microbiology, 2014, 116(5): 1067-1083.
[3] 刘丽艳, 张喜梅, 李琳, 等. 超声波杀菌技术在食品中的应用[J]. 食品科学, 2006, 27(12): 778-780.
[4] 蒋丽芬, 廖红梅. 低温辅助超声波诱导活的非可培养状态鼠伤寒沙门氏菌及复苏研究[J]. 2017, 3(17): 1-9.
[5] EVELYN, SILVA F V M. Differences in the resistance of microbial spores to thermosonication, high pressure thermal processing and thermal treatment alone [J]. Journal of Food Engineering, 2018, 222 (3): 292-297.
[6] MANAS P, PAGAN R, RASO J. Predicting lethal effect of ultrasonic waves under pressure treatments on Listeria monocytogenes ATCC 15313 by power measurements[J]. Journal of Food Science, 2000, 65 (4): 663-667.
[7] TREMARIN A, BRANDÃO T R S, SILVA C L M. Application of ultraviolet radiation and ultrasound treatments for Alicyclobacillus acidoterrestris spores inactivation in apple juice[J]. LWT - Food Science and Technology, 2017, 78(3): 138-142.
[8] CHAR C D, MITILINAKI E, GUERRERO S N, et al. Use of high-intensity ultrasound and UV-C light to inactivate some microorganisms in fruit juices[J]. Food & Bioprocess Technology, 2010, 3(6): 797- 803.
[9] PALGAN I, MUÑOZ A, NOCI F, et al. Effectiveness of combined pulsed electric field (PEF) and manothermosonication (MTS) for the control of Listeria innocua in a smoothie type beverage [J]. Food Control, 2012, 25(2): 621-625.
[10] 毕秀芳, 陈丽伊, 潘泓桦, 等. 超声波结合 nisin 对胡萝卜汁的杀菌效果[J]. 中国食品学报, 2018, 18 (1): 211-216.
[11] BILEK S E, TURANTAS F. Decontamination efficiency of high power ultrasound in the fruit and vegetable industry, a review[J]. International Journal of Food Microbiology, 2013, 166(1): 155-162.
[12] ASHOKKUMAR M. The characterization of acoustic cavitation bubbles - an overview[J]. Ultrasonics Sonochemistry, 2011, 18(4): 864-872.
[13] SERPE L, GIUNTINI F. Sonodynamic antimicrobial chemotherapy: First steps towards a sound approach for microbe inactivation[J]. Journal of Photochemistry & Photobiology B: Biology, 2015, 150(3): 44-49.
[14] KENTISH S, ASHOKKUMAR M. The physical and chemical effects of ultrasound[M]. New York: Springer, 2011: 1-12.
[15] JOSÉ J F B D S, ANDRADE N J D, RAMOS A M, et al. Decontamination by ultrasound application in fresh fruits and vegetables[J]. Food Control, 2014, 45(1): 36-50.

 >
>