晋西北不同土地管理方式对土壤碳氮、酶活性及微生物的影响
时间:
摘要: 晋西北丘陵区受干旱大风气候以及人为活动的影响,土壤肥力较低,土壤质量退化严重,不同的土地利用和管理方式,因植被覆被、人为活动等不同,对土壤质量产生影响不同。为了更好地了解晋西北地区不同土地管理方式对土壤质量的影响,于山西省北部忻州市五寨县,研究不同管理方式对土壤肥力、土壤酶活性、微生物群落结构及多样性的影响,以及微生物与土壤环境因子的关系,为晋西北地区土地管理和生态建设提供参考。研究中设置 4 种土地管理方式: 苜蓿样地( MX) 、免耕样地 ( MG) 、翻耕样地( FG) 和荒地( HD) ,采用野外采集土壤样品、室内测定和分析的研究方法,其中土壤 pH 值利用电位法测定,土壤有机碳( OC) 采用重铬酸钾氧化-分光光度法测定; 土壤硝态氮、铵态氮利用全自动间断化学分析仪测定,其原理为紫外分光光度和靛酚蓝比色法。土壤过氧化氢酶、蔗糖酶、脲酶和磷酸酶活性分别采用 KMnO4滴定法、3,5-二硝基水杨酸法、苯酚钠-次氯酸钠比色法、磷酸苯二钠比色法测定,采用高通量测序测定土壤细菌和真菌的群落组成,利用统计分析软件 SPSS 和 Canoco 以及 QIIME、USEARCH 和 Uclust 生物信息软件分析不同土地管理方式对土壤质量的影响。结果表明,不同土地管理方式对土壤化学性质、土壤酶活性、细菌和真菌的群落结构及多样性均有影响。苜蓿和免耕 2 种土地管理方式可显著提高表层土壤养分并增加土壤酶活性; 4 种土地管理方式共有 9 个细菌门和 11 个真菌门,细菌相对丰度较大的为变形菌门、放线菌门和酸杆菌门,真菌的子囊菌门相对丰度最大; 苜蓿和免耕样地土壤细菌和真菌群落丰富度和多样性都较高,荒地土壤细菌和真菌群落丰富度较低,但多样性较高; RDA 分析结果表明,土壤 pH、NH+ 4 -N 和 NO- 3 -N 含量和过氧化氢酶活性对细菌群落影响较大,pH、有机碳含量、蔗糖酶、脲酶和过氧化氢酶活性对真菌群落影响最大。苜蓿和免耕 2 种土地管理方式能够提高土壤质量,是晋西北地区较为适宜的管理措施。
关键词: 土地管理; 土壤酶; 土壤微生物; 土壤养分
土地利用和管理是人类利用土地各种活动的综合反映,是影响土壤肥力变化的主要因素[1]。不同的土地利用和管理方式,因植被覆被( 草地、荒地、农地) 、人为活动( 耕作和免耕) 等不同,对土壤理化性状产生影响,进而影响土壤酶活性在土壤垂直方向上的分布[2],并对土壤微生物群落结构和多样性产生影响[3-4]。土壤酶在土壤生态系统的物质循环和能量流动方面扮演着重要角色,它参与土壤的发生发育以及土壤肥力形成和演化的全过程,具有高度催化作用[5]。土壤酶活性可反映土壤中生物化学过程的强度和方向,可作为评价土壤肥力状况的指标,也可作指示土壤生态系统的健康和可持续性以及土地管理引起为土壤质量变化的生物活性指标[6-8]。有研究表明,肥料、作物残体和耕作管理方式可影响土壤酶的分布和活性[9-10]
土壤微生物群落是土壤重要的活体成分,作为土壤养分转化和循环的催化剂,是土壤碳氮元素矿化的来源,其数量和活性是评价土壤质量的重要指标[11]。土壤微生物对环境变化具有敏感性,不同的管理方式、土壤、植被条件下,微生物各群落对环境因素的响应不同,对其数量的消长和种群结构可产生较大的影响[12]。土壤微生物与土壤酶紧密联系,在土壤生态系统服务传递过程中扮演重要的角色[13],两者参与有机物质分解和合成,以及无机物的氧化与还原的过程,因此是土壤生态系统代谢的重要动力[14]。
为了更好地了解晋西北地区不同土地管理方式对土壤质量的影响,本试验在山西省北部忻州市五寨县设置四种土地管理方式,苜蓿样地、免耕样地、翻耕样地和荒地( 对照) ,研究不同管理方式对土壤肥力、土壤酶 ( 蔗糖酶、磷酸酶、过氧化氢酶、脲酶) 活性的影响,分析不同管理方式土壤微生物群落结构和多样性,以及微生物与土壤环境因子的关系,评估不同土地管理方式对土壤质量的影响,以期为晋西北地区土地管理和生态建设提供参考。
1 材料与方法
1.1 区域概况
研究区位于山西省忻州市五寨县胡会乡石咀头村,具体地理位置为 111°28'—113°E 和 38°44'—39°17' N,涵盖华北黄土高原的半干旱区和沙区。该区属于温带大陆性气候,冬季受蒙古西伯利亚高压控制,长而严寒,且雨雪偏少; 春季干旱多风,气候干燥; 夏季气温适中且雨量高度集中; 该地区昼夜温差大,年平均气温 4.9℃左右,1 月最冷( -13.3℃ ) ,7 月最热( 20.1℃ ) 。无霜期 120 d 左右,有效积温 2452℃,该区年平均降雨量在 450—500 mm 之间,降水多集中于 7 月和 8 月,约占年降水量的 44%。根据中国土壤分类系统,研究区土壤为沙黄土,与土壤分类学中认为典型旱成土相似,土壤质地松散,孔隙度高,渗透性好,通气性强,肥力低,土壤有机质含量低[15]。
1.2 研究方法
1.2.1 样地选择及设置
2015 年 8 月下旬于山西省忻州市五寨县石咀头村,选择四种在当地具有代表性的土地利用和管理方式进行试验研究: 研究中选取的 100 m( 长) × 80 m( 宽) 的地块,在实验当地进行调查,该地块自 1965 年开始未受到人为干扰。该地块在实验前,为撂荒地,自 2008 年开始,对该地块进行开垦。当地主要以传统翻耕种植玉米为主,且多为多年连作的方式。本研究中的 4 块实验样地,每一块实验样地为 100 m( 长) × 20 m( 宽) ,4 块实验样地具体设置如下: 一块样地种植紫花苜蓿,从 2008—2015 年未进行耕作( 免耕苜蓿样地 MX) ,苜蓿自 2008 年种植后,每年秋季不进行收割,不进行任何耕作措施; 另一个样地于 2008 年春季,进行常规的翻耕起垄,于常规耕作下 2008—2015 年种植玉米( Zea mays L.) ( 翻耕样地 FG) ,于每年春季播种前翻耕一次,翻耕深度约为 50 cm,秋季籽实收获后,地上部分秸秆于第二年春季移除地块; 第三块样地于 2008 年春季,采用免耕播种机进行播种,于 2008—2015 年免耕种植玉米( 免耕样地 MG) ,秋季籽实收获后,秸秆全部粉碎覆盖于地表; 最后一个地块不进行任何耕种措施( 荒地 HD) ,地表主要以草本为主,且植被覆盖较少。
1.2.2 样品采集及预处理
本实验在每个样地各设置 10 m×10 m 样方 3 个,在每个样方内设置 5 个取样点,采用 5 点混合取样法采集土壤样品,即利用对角线法选取 5 个点,首先去除地表植被和覆盖物,再用土钻钻取 0—50 cm 深的土壤样品,从上至下 10 cm 等间距取样,每一个样方内采集土壤样品数为: 5 个采样点×5 深度= 25 个,进行 5 点混合,即将每个深度上的 5 个采样点的土壤样品进行等量均匀混合,后最终每个样方内土壤样品数为 5 个,每个样地 3 个样方,每个样地的土壤样品数为 15 个。每个样品取样重量 200—300 g,将所取的新鲜土样分为两份,用无菌自封袋密封,置于冰盒尽快带回实验室,并于-20℃下保存。在 24 h 之内,将每个样地的同一土层深度的 5 个土壤样品混合均匀并过直径为 2 mm 的网筛,除去根系、石块等杂物。其中一部分风干后用于土壤化学性质的测定; 另一部分放入-80℃冰箱保存,用于土壤酶活性测定和和高通量测序。
1.2.3 土壤化学性质和酶活性测定
土壤 pH 值( 1∶2.5) 采用电位法测定[16]。土壤有机碳( OC) 采用重铬酸钾法进行测定; 土壤硝态氮和铵态氮采用全自动间断化学分析仪进行测定( CleverChem 380,Germany) 。土壤过氧化氢酶的测定采用 KMnO4滴定法; 其活性以 20 min 内每 g 土壤分解的过氧化氢毫克数表示; 土壤蔗糖酶的测定采用 3,5-二硝基水杨酸法,其活性以 37℃下培养 24 h 后 1 g 土壤中生成的葡萄糖毫克数表示; 土壤脲酶的测定采用苯酚钠-次氯酸钠比色法,其活性以 37℃下培养 24 h 后 1 g 土壤中生成 NH+ 4-N 的毫克数表示; 土壤磷酸酶的测定采用磷酸苯二钠比色法,其活性以 37℃下培养 24 h 后 1 g 土壤中生成酚的毫克数表示[17]。
1.2.4 样品 DNA 提取和高通量测序
将四个样地的所采取的 0—10 cm 深度的 3 个重复土壤样品和 10—20 cm 深度的 3 个重复土壤样品均匀混合为一个样品后,分别称取 0.5 g,用于 DNA 提取: 利用土壤试剂盒( PowerSoil? DNA Isolation 试剂盒) 按照试剂盒操作步骤提取样本的 DNA.将提取的基因组 DNA,利用引物序列 520F( AYTGGGYDTAAAGNG) 和 802R ( TACNVGGGTATCTAATCC ) 对 细 菌 16S rDNA 高 变 区 V4 区 进 行 扩 增; ITS1F ( TCCGTAGGTGAACCTGCGG) 和 ITS2R( GCTGCGTTCTTCATCGATGC) 对真菌 ITS1 区 2 域进行扩增。利用引物序列 PCR 反应条件为: 98℃预变性 30 s; 98℃变性 30 s; 50℃退火 30 s; 72℃延伸 30 s; 27 个循环; 72℃ 保温 5 min,在 4℃下保存。扩增结果进行 2%琼脂糖凝胶电泳,最后将扩增产物进行 Illumina MiSeq 高通量测序与分析。本研究的测序和生物信息服务在上海派森诺生物科技有限公司完成。
1.3 数据处理与分析
微生物群落 OTU 分析: 首先运用 QIIME 软件识别疑问序列: 软件剔除长度小于 50 bp 的序列以及序列尾部质量值在 20 以下的碱基,再对低复杂度的序列进行过滤,去除预处理后序列中的非扩增区域序列,并利用 USEARCH 检查并去除序列中的嵌合体。再利用 Uclust 软件对符合要求的序列在 97%的相似水平上进行 OUT 聚类,并采用 Greengene 数据库对所得序列进行比对分析,最后以 97%的相似性作为阈值划分操作分类单元( OTU) 。
2 结果与分析
2.1 土壤化学性质
表 1 所示,4 个样地土壤 pH 在 0—50 cm 深度都呈现碱性( 8.56—9.63) ,在 0—40 cm 深度,翻耕样地 ( FG) 和荒地( HD) 土壤 pH 无显著差异,且总体上显著高于免耕( MG) 和苜蓿( MX) 样地。土壤有机碳含量总体表现为免耕样地最高,荒地最低,两个样地土壤有机碳差异具有显著性。且在 0—40 cm 深度,苜蓿样地土壤有机碳含量也显著高于荒地。4 个样地土壤硝态氮( NO- 3-N) 含量在 0—50 cm 深度都呈现出免耕和苜蓿样地( 6.64—13.34 mg /kg) 显著高于翻耕样地和荒地( 0.54—7.49 mg /kg) 。苜蓿样地表层土壤( 0—20 cm) 氨态氮( NH+ 4-N) 含量显著高于其他样地,翻耕氨态氮含量较低。而在 20—40 cm 深度,免耕样地氨态氮含量最高,荒地最低。
相关知识推荐:土壤有机质生态效应论文如何选刊发表
2.2 土壤酶活性
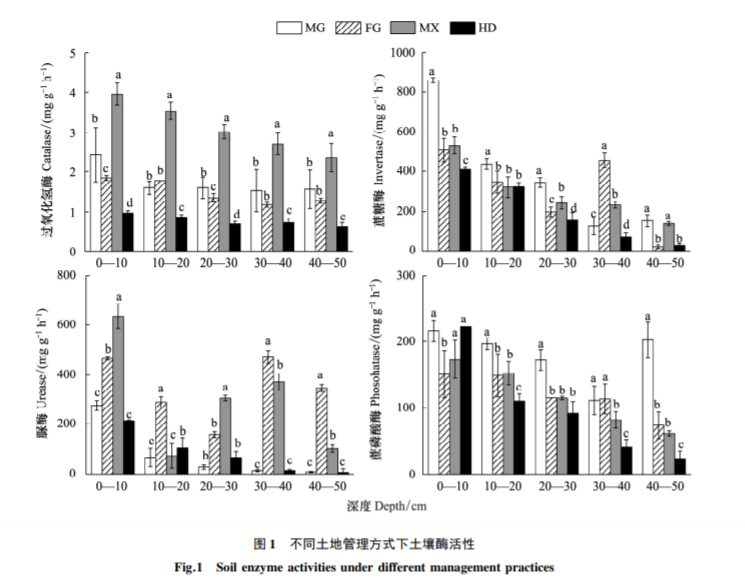
土壤酶主要来源于动植物及微生物细胞的分泌及其残体的腐解。在 0—50 cm 土层深度,4 个样地的土壤过氧化氢酶随深度的增加变化趋势基本一致,即都随着土层深度的增加而降低。苜蓿样地 0—50 cm 深度土壤过氧化氢酶活性变化范围为 2.36—3.95 mg g-1 h-1 ,显著高于其他样地,而荒地土壤过氧化氢酶活性变化范围为 0.62—0.97 mg g-1 h-1 ,显著低于其他样地。在 0—30 cm 土层,不同土地恢复模式对土壤蔗糖酶活性影响一致,免耕样地土壤蔗糖酶活性显著高于其他样地,表层 0—10 cm 酶活性值最高( 860 mg kg-1 h-1 ) ,,而荒地蔗糖酶活性最低; 而 30—40 cm,蔗糖酶活性在四个样地之间呈现显著性差异,表现为: 翻耕>苜蓿>免耕>荒地。4 种土地恢复模式下,土壤脲酶基本表现为 0—10 cm 深度活性最高,苜蓿样地的脲酶活性在 0—10 cm 和20—30 cm 显著高于其他样地,而在 10—20 cm 和 30—50 cm,翻耕样地脲酶活性显著高于其他样地。总体上,苜蓿和翻耕样地脲酶活性显著高于其他两样地。不同土地管理方式对土壤磷酸酶活性的影响,表现为 0—10 cm 土层,翻耕样地显著低于其他样地; 10—50 cm 土层,总体表现为免耕样地土壤磷酸酶活性最高,荒地最低; 其中在 10—30 cm 和 40—50 cm,免耕样地磷酸酶活性显著高于其他样地( 图 1) 。
2.3 土壤微生物群落分布
2.3.1 门水平土壤优势菌群分布特征
4 个样地土壤微生物在门水平上细菌相对丰度大于 1%的共有 9 个门,分别是变形菌门( Proteobacteria) 、放线菌门( Actinobacteria) 、酸杆菌门( Acidobacteria) 、绿弯菌门( Chloroflexi) 、浮霉菌门( Planctomycetes) 芽单胞菌 门 ( Gemmmatimonadetes) 、疣 微 菌 门 ( Verrucomicrobia ) 、硝 化 螺 旋 菌 门 ( Nitrospirae ) 和 拟 杆 菌 门 ( Bacteroidetes) 。其中变形菌门所占的相对丰度最大( 21.4%—23.0%) ,其次是放线菌门和酸杆菌门,相对丰度分别为 18.7%—23.0%和 17.5%—19.9%。4 个样地的细菌在门水平上的群落分布存在一定的差异。对丰度最大的变形菌门在 4 个样地的相对丰度表现为: 翻耕( 25%) >荒地( 23%) >苜蓿( 22%) >免耕( 21%) ; 放线菌门、酸杆菌门和绿弯菌门在免耕样地相对丰度都最大( 图 2) 。4 个样地在门水平上的优势真菌相对丰度大于 1%的共有 11 个门,主要包括子囊菌门( Ascomycota) 、接合菌门( Zygomycota) 和担子菌门( Basidiomycota) ,相对丰度分别为 61.4%—72.8%、1.3%—18.6%和 4.6 %—14.1%,未命名的菌门占 0.7%—14.8%( 图 3) 。相对丰度最大的子囊菌门在 4 个样地的相对丰度表现为: 苜蓿>免耕>翻耕>荒地。接合菌门在翻耕样地的相对丰度最大( 19%) ,荒地最小( 1.3%) ; 担子菌门在荒地的相对丰度最大( 21%) ( 图 3) 。
2.3.2 纲水平土壤优势菌群分布特征
对细菌群落的变形菌门( A) 、放线菌门( B) 、酸杆菌门( C) 和绿弯菌门( D) 以及真菌群落的子囊菌门( E)和担子菌门( F) 的菌群在纲水平上进行分析( 图 4) ,4 个样地中#-变形菌纲( Alphaproteobacteria) 是变形菌门中相对丰度最大的菌群,约占比例 50.9%—64.0%,其次是 β-变形菌纲、γ-变形菌纲和 δ-变形菌纲,约占比例分别为 13.8%—22.2%、9.6%—16.9%和 9.8%—12.3%( 图 4A) 。组成放线菌门的菌群有 7 个纲,相对丰度较高的为放线菌纲、嗜热菌纲、酸微菌纲和 MB-A2-108,放线菌纲和嗜热菌纲为优势放线菌,所占比例分别为 38.5%—53.8%和 25.2%—35.9%,而酸微菌纲和 MB-A2-108 所占比例较低( 图 4B) 。酸杆菌门中相对丰度较高的菌群是 6-酸杆菌纲和 Chloracidobacteria,所占比例为 60.2%—64.1%和 25.2%—29.9%( 图 4C) 。绿弯菌门中主要有厌氧绳菌纲( Anaerolineae) 、绿弯菌纲( Chloroflexi) 、Ellin6529 和 Gitt-GS-136,其中厌氧绳菌纲、绿弯菌纲和 Ellin6529 相对丰度较高,分别占 18.5%—30.0%、21.4%—29.1%和 18.8%—37.6%( 图 4D) 。真菌群落的子囊菌门中古菌根菌纲( Archaeorhizomycetes) 所占相对丰度比例最高,4 个样地所占比例基本相同,其次为座囊菌纲( Dothideomycetes) 、散囊菌纲( Eurotiomycetes) 、粪壳菌纲( Sordariomycetes) ,所占比 例 分 别 为 3.37%—6. 90%、1. 60%—2. 24% 和 17. 9%—30. 8% ( 图 4E ) 。组成担子菌门的菌纲 主要有伞菌纲 ( Agaricomycetes) 、银耳纲( Tremellomycetes) ,以及未确定和命名分类的菌纲,其中伞菌纲和银耳纲相对丰度较高,分别为 33.4%—76.2%和 18.8%—59.7%( 图 4F) ,另外一个相对丰度较高的接合菌门,其纲水平的菌种未确定。
2.4 土壤微生物群落#多样性
基于序列在 97%的相似水平上进行 OUT 聚类,4 个样地微生物#多样性见表 2。Chao1 和 ACE 用来衡量群落丰富度指数,指数越大,其丰富度越高,而 Shannon 指数值越高,表明群落的多样性越高。表 2 所示,苜蓿样地土壤细菌群落丰富度最高,Chao1 和 ACE 指数分别为 8064.43 和 8553.70,其次为免耕样地,Chao1 和 ACE指数分别为 7668. 94 和 8311. 15,荒地最低( Chao1 为 5812.21,ACE 为 5911. 68) 。苜蓿样地土壤细菌群落 Shannon 指数最高( 10.50) ,说明苜蓿样地土壤细菌群落多样性最高,其次为荒地( 10.45) 和免耕( 10.42) ,翻耕样地土壤细菌群落多样性最低,Shannon 指数为10.32 ( 表 2) 。对真菌群落进行分析,免耕样地土壤真菌群落丰富度最高,Chao1 和 ACE 指数分别为 926.00 和 1060. 44,其次是苜蓿和翻耕样地,荒地最低。免耕样地的 Shannon 指数最高( 6.92) ,表明免耕样地土壤真菌群落多样性最高,其次为苜蓿和荒地,翻耕样地土壤真菌群落多样性最低,Shannon 指数为 6.00( 表 2) 。总体上,苜蓿和免耕样地土壤细菌和真菌群落丰富度和多样性都较高,翻耕样地土壤细菌和真菌群落丰富度较高,但多样性较低,而荒地土壤细菌和真菌群落丰富度较低,但多样性较高。
2.5 土壤微生物优势菌群与土壤化学性质的关系
对土壤微生物优势细菌和真菌群落相对丰度和土壤环境因子进行 RDA 冗余分析( 图 5) ,图中大写字母多对应的微生物种类见表 3,分析结果显示,细菌丰度分布在第一轴和第二轴累计解释变量分别达到 74.2% 和 92.4%,对于真菌丰度分布在第一轴和第二轴累计解释变量分别达到 67.1%和 95.3%。土壤细菌群落优势菌群的相对丰度与土壤环境因子冗余分析,结果( 图 5) 显示酸杆菌门( Acidobacteria) 主要集中在排序轴左侧,与 pH 呈显著正相关关系,与硝态氮、铵态氮和过氧化氢酶呈负相关关系; 变形菌门中的主要变形菌纲 B1 与硝态氮、铵态氮和过氧化氢酶呈正相关关系,而与 pH 呈负相关关系; 放线菌门主要集中在排序轴右侧,其与硝态氮、铵态氮和过氧化氢酶显著正相关关系; 绿弯菌门中的 D1、D3 与 pH 呈正相关关系,而 D2、D4 与硝态氮、铵态氮和过氧化氢酶呈负相关关系。土壤真菌群落优势菌群的相对丰度与土壤环境因子冗余分析,结果 ( 图 5) 显示,子囊菌门( Ascomycota) 的优势菌集中在排序轴右侧,与硝态氮、铵态氮和过氧化氢酶呈正相关关系,而与脲 酶 和 pH 呈 负 相 关 关 系,其 中 E2、E4 菌纲还与蔗糖酶和有机碳呈正相关关系; 担 子 菌 门 ( Basidiomycota) 的优势菌菌纲 F1 与硝态氮、铵态氮、过氧化氢酶、蔗糖酶和有机碳呈正相关关系,与脲酶和 pH 呈负相关关系,F2 与脲酶和 pH 呈正相关关系,与硝态氮、铵态氮和过氧化氢酶呈负相关关系; 接合菌门 ( Zygomycota) 与 pH、脲酶和有机碳呈正相关关系,而与硝态氮、铵态氮和过氧化氢酶呈负相关关系。 ——论文作者:刘 爽1,2 ,王 雅1 ,刘兵兵1 ,刘海龙3,* ,刘 勇1

 >
>