胡萝卜多糖结构与功能及其在食品加工过程中的变化
时间:
摘要 胡萝卜肉质根可供食用和药用,富含 β-胡萝卜素、维生素 C、多糖等多种营养功能成分,尤其是果胶等膳食纤维含量很高,是一种廉价的营养食品原料。 本文对近年来国内外胡萝卜多糖相关研究进行综述,重点介绍胡萝卜多糖结构、功能以及食品加工对其多糖结构与功能特征的影响,并就目前存在的问题和今后发展方向提出建议,以期为胡萝卜多糖结构和功能的系统、深入研究和应用开发提供参考。
关键词 胡萝卜; 多糖; 结构; 功能; 食品加工
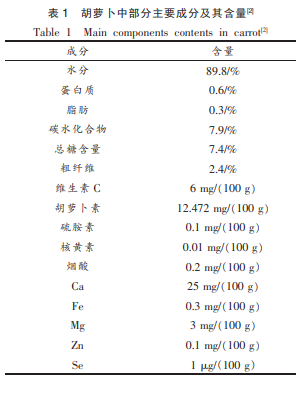
胡萝卜(Daucus carota)原产于欧洲及西亚,现广泛分布于世界各地, 属伞形科(Umbelliferae)草本植物,其肉质根供食用和药用,素有“小人参” 之称。 据不完全统计,胡萝卜中含有胡萝卜素、维生素 C、挥发油、倍半萜类、黄酮类和香豆素等诸多营养成分[1],尤其富含多糖化合物,特别是其中果胶等膳食纤维含量很高。 表 1 列举了胡萝卜中主要成分的含量[2]。
多糖是胡萝卜中的主要化学成分, 胡萝卜多糖具有良好活性功能,包括具有吸附葡萄糖,降低淀粉酶活性的作用, 表明其具有控制餐后血糖水平的能力[3]。 胡萝卜中的中性糖虽可消化性较差[4],但和由岩藻糖、木糖和葡萄糖组成的多糖相比,由鼠李糖、 阿拉伯糖和半乳糖组成的中性果胶类多糖更容易消化,而其中的酸性多糖也更容易消化[4]。夹带了 β-胡萝卜素和多酚化合物的胡萝卜皮膳食纤维具有一定的抗氧化能力[5]。 食品加工对胡萝卜多糖理化指标和功能有很大影响, 同时多糖结构的变化又影响胡萝卜质构, 相关研究一直受到广泛关注。 纵观国内外,虽有许多有关胡萝卜化学成分[1,6-8]、加工[7,9] 、栽培[10-11]等方面的综述性文章,但尚未见胡萝卜多糖结构、 功能及其在食品加工过程的变化等综述性报道。 鉴于此,本文主要综述近 10 年来国内外有关学者在胡萝卜多糖结构、功能及其在食品加工过程的变化等方面的内容,以期使大家能更好地关注胡萝卜中的多糖类成分,为相关课题的深入研究和工业加工提供更多参考和支持。
1 胡萝卜多糖的提取方法
多糖广泛存在于动、植物和微生物中,来源广泛,属于极性大分子化合物,可以采用不同温度的水、稀碱溶液提取,也可以在酸性条件下提取[12]。 上述提取方法也可以依次采用,以提取不同性质类型的多糖化合物。 由于胡萝卜主要的多糖类型为果胶,因此根据果胶的特殊性质可以依次采用水提、CDTA(或 EDTA)、弱碱螯合等方式从胡萝卜中提取,分别得到水溶性果胶、CDTA 螯合果胶和弱碱螯合果胶等不同性质的多糖,同时可采用超声、微波、酶解等方法辅助提取,提高多糖得率。 不同提取方法获得胡萝卜多糖的相对分子质量存在一定差异[13-14],一般都小于 50 万[13,15- 16], 有少数报道胡萝卜多糖相对分子质量超过了 50 万[14,17]。
国内学者孙玉军等[18]采用正交试验优化胡萝卜中水溶性多糖的提取条件, 结果显示最佳提取工艺为提取温度 60 ℃、 料液比 1∶30、 提取时间 8 h、pH 值为 11,在此条件下多糖提取率为 21.27%。微波法可以大大缩短胡萝卜多糖的提取时间,提取率可以增加 9.59%[19]。 此外,采用超声波辅助提取的方法也可以缩短胡萝卜果胶的提取时间[20],这可能是由于超声法加速了果胶从胡萝卜颗粒中溶出[21-22]。
上述提取方法强调的是以多糖得率为目标的提取方法,而胡萝卜中含有不同性质的果胶,更科学、合理的提取方式是采用不同溶剂依次提取。 孙雅 君 [22] 对 醇 不 溶 性 (Alcohol -insoluble fraction, AIP)胡萝卜渣分步提取水溶性组分(Water-soluble fraction,WSP)、 草酸溶性组分 (Oxalic acidsoluble fraction, OSP)、酸溶性组分(Acid-soluble fraction,ASP), 用以研究胡萝卜肉质根发育期间果胶的组成与变化。 国外很多学者也采用分步提取方法从胡萝卜的 AIP 中提取水溶性果胶 WSF、螯合性组分(Chelator-soluble fraction,CSF)、碳酸钠可溶性组分(Sodium carbonate-soluble fraction, NSF) 或半纤 维 素 组 分 (Hemicellulosic fraction, HF),用于相关研究[13,15,23]。Houben 等[13]从胡萝卜中依次提取了 WSF、CSF、NSF 和 HF 组分,其总量占胡萝卜乙醇不溶性物质的 83.9%。
2 胡萝卜多糖基本理化性质和结构特征
有关胡萝卜多糖结构特征, 目前报道较多的是其基本理化性质和单糖组成等。 表 2 列举了不同方法提取的胡萝卜多糖单糖组成等信息。 前面已阐述胡萝卜中的多糖主要是果胶类成分, 其主要组成单糖是果胶类单糖, 如 Ara、Gal、GalA 等。李洋 等[24]采用酸法提取的胡萝卜多糖以 Gal 和 GalA 为主,而阚国仕等[25]利用 DEAE-cellulose 52 从胡萝卜水提多糖中分离得到的 DCP2 组分主要含有 Rha、Ara 和 Gal,GalA 含量相对较少,这有可能与其分离纯化方法有关。
相对而言, 国外学者在胡萝卜多糖的结构特征解析方面更加深入。 Houben 等[13]从胡萝卜中提取、 分离得到各类多糖组分 AIR、WSF、CSF、NSF 和 HF,结构研究显示:上述 5 种组分中主要的糖醛酸 为 GalA, 其它 单 糖 主 要 有 Gal、Glc 和 Ara, AIR、WSF 和 CSF 高度甲酯化,通过分析相关单糖的 比 例 推 测 WSF、CSF 和 NSF 中可能主要含有 RG-1 型果胶。 Immerzeel 等[15]也有类似发现:胡萝卜来源的水溶性组分中 Ara 和 Gal 摩尔百分比为 26%和 59%,GalA 的含量为 6%,同时检测到少量 GlcA(6%),而 EDTA 螯合组分中的 GalA 摩尔百分比高达 77%, 稀碱提取的胡萝卜组分中则是以 Ara(16%)、Gal(17%)和 GalA(56%)为主,并通过深入研究发现胡萝卜中的阿拉伯半乳糖蛋白和其果胶发生相互交联。 胡萝卜中的阿拉伯半乳糖蛋白基本仅含有少量 GalA,Ara 主要以末端残基形式存在, 而 Gal 则有 1,3-,1,6-和 1,3,6-连接几种形式, 多糖链为典型的 II 型阿拉伯半乳糖[26]。 Deco 等[27]采用酶解结合凝胶柱色谱的方法从胡萝卜中分离得到 RG-II 型果胶多糖, 其糖残基结构类型十分复杂, 该作者仅给出各残基连接方式信息,主要糖残基包括 T-Rhap,T-Araf,T-GalAp,1, 4-GalAp 和 1,3,4-GalAp, 更详细的多糖精细结构还有待挖掘。 目前, 除了检测到常见的 Rha、 Ara、Gal 和 GalA 等单糖,胡萝卜中还有少量 2-OCH3-Fuc、芹菜糖等类型的糖[27],以 及 甘 露 糖 醇(trace~1.3 mg/g 干质量胡萝卜),肌醇(2.2~9.8 mg/ g 干质量胡萝卜),鲨肌醇(1.5~5.8 mg/g 干质量胡萝卜) 和景天庚酮糖 (1.4~24.6 mg/g 干质量胡萝卜)[28]。 胡萝卜多糖结构的多样性,除了与提取、纯化方法有关外, 还与胡萝卜来源也存在一定关系[29]。
一些学者还对成熟和贮藏期间胡萝卜多糖结构的变化做了深入分析, 阐述化学成分变化和胡萝卜质构之间的关系。 Ng 等采用溶剂分步萃取的方式, 从胡萝卜中提取、 分离得到水溶性果胶、 CDTA 螯合果胶和 CDTA 螯合后的残渣, 研究上述组分在成熟过程和贮藏中的变化情况, 结果发现胡萝卜种植后的第 8 周, 水溶性果胶含量为 23%,到 16 周(此时胡萝卜成熟)时下降至 16%,与此同时CDTA 螯合果胶和 CDTA 不可螯组分胶含量上升[31]。 贮藏期间水溶性果胶含量持续下降(小于 8%),甲酯化度也下降[31]。瑞典学者 Galindo[32] 在研究胡萝卜贮藏过程中的细胞壁化学成分变化方面更加深入, 在前 7~12 周的贮藏期内,Gal 和 Ara 含量有些下降, 而其它碳水化合物以及甲酯化度并没有发生明显的改变[32]。 除了果胶对胡萝卜质构的贡献作用外, 伸展蛋白的氧化交联作用是胡萝卜质构在贮藏过程中变强的一个原因。 化学结构往往影响物质的流 变特性 ,Mierczyńska 等[23]研究发现,胡萝卜中的水溶性果胶、CDTA 螯合果胶和稀碱溶性果胶的黏度在贮藏过程中是升高的, 这可能与胡萝卜经相关酶的作用使得果胶内部发生重排,从而影响了其流变特性,进而影响胡萝卜的质构,具体机制还需深入分析。
胡萝卜在生长、发育过程中的多糖结构变化,特别是胡萝卜果胶对于其细胞壁的黏附性有很大影响,后者又影响胡萝卜的组织形态。 Kikuchi 等[33] 发现从胡萝卜组织培养获得的细胞中提取得到的果胶,含有较多 Xyl,其以末端残基的形式直接和聚半乳糖醛酸主链上的 O-2 或 O-3 相连, 而 Xyl 可能通过酚酸类化合物和细胞壁上的半纤维素细胞相连接。 同时其它一些中性糖如 Ara 和 Gal 可能也参与胡萝卜果胶类多糖的细胞间作用[34]。 综合诸多文献报道, 更深入的胡萝卜多糖精细结构和构象特征报道不多。
3 胡萝卜多糖的功能
许多天然产物来源的多糖具有较好的生物活性,如免疫调节,抗肿瘤,降血糖和降血脂,促进肠道健康以及抗氧化等功能[12,35-36]。 胡萝卜多糖也具有较多的活性功能,如抗氧化,血糖调节等。 孙玉军等[37]发现采用热水法提取的胡萝卜多糖具有较好的体外抗氧化活性, 对·OH、O2 ·- 、DPPH 自由基具有较强的清除能力, 对卵黄脂蛋白脂质过氧化也有抑制作用。 刘立新等[38]报道胡萝卜多糖具有体外抗氧化作用。 胡萝卜多糖的抗氧化性可能与其中含有的 β-胡萝卜素和酚类化合物有一定关系[5] 。 硫酸化修饰能提高胡萝卜多糖的抗氧化能力[39]。
胡萝卜中富含的多糖化合物包括可溶性膳食纤维和不可溶性膳食纤维, 不可溶性膳食纤维由细胞壁成分组成,如纤维素、半纤维素和木质素。胡萝卜中的可溶性膳食纤维则主要由果胶等成分组成[7]。 Chau 等[3]发现胡萝卜中水不溶性纤维具有显著的功能性质, 包括葡萄糖吸收能力和抑制淀粉酶活性,这对于控制餐后血糖有很大帮助。 胡萝卜中性糖组分(果胶)不容易在体内消化降解,而相同条件下果胶提取物中的岩藻糖、 木糖和葡萄糖会优先消化,酸性糖部分则相对容易被消化[4]。果蔬中的多酚和细胞壁成分对健康有益, 研究显示胡萝卜细胞壁(主要是多糖)会影响酚酸和花青素的释放,在体外实验中只有大约 20%的花青素、 30%酚酸经胃和小肠消化液作用后会被释放,这种不完全释放作用有利于肠道中的菌群能够获得多酚类化合物[40]。 良好的肠道菌群对于维持机体健康有着重要作用和影响[41],然而现阶段缺乏胡萝卜多糖作用的机体肠道菌群变化、 次生代谢产物及其对机体健康影响等方面的深入研究。 本实验室研究人员对胡萝卜汁的肠道菌群益生作用做了初步研究, 结果显示每天给予糖尿病大鼠“10 mL 胡萝卜汁/(kg 大鼠体质量)”剂量灌胃,能显著加大鼠粪便中丙酸、 丁酸和总短链脂肪酸的分泌量[42],不过其物质结构作用基础仍有待确证。 胡萝卜中另一大类化合物是小分子的 β-胡萝卜素,其生物利用率也会受到胡萝卜中果胶的影响, 胡萝卜果胶是胡萝卜细胞壁的主要成分之一, 其果胶结构受到外界作用被破坏后, 胡萝卜的质构发生改变(变得柔软),使得 β-胡萝卜素生物利用率提高[43]。
4 食品加工方式对胡萝卜多糖结构与功能的影响
无论国内还是国外, 人们总是会将从农场收集得到的胡萝卜进行加工处理,如灌装,干燥,制作成胡萝卜汁、糖果和食品添加剂等,期间可能需要 经 历 漂 洗、浸 煮、杀 菌、高压或均质等诸多工艺[7]。 胡萝卜的品质在加工过程中会受到很大影响, 对于维持胡萝卜质构起到非常重要作用的多糖类成分变化是其质构发生变化的主要原因之一。 正因如此,加工方式对胡萝卜及胡萝卜多糖理化指标、结构和功能作用的影响,一直受到广泛关注。
漂洗作用会降低胡萝卜中半乳糖醛酸和总糖含量,而不同的作用方式结果又有所区别,高温瞬时漂洗会使果胶、 甲酯化果胶和中性糖中保留更多的半乳糖醛酸或总糖[44]。 在加热漂洗过程中引入超声技术,可以显著缩短处理时间,达到较好的灭酶活(过氧化物酶和果胶甲酯化酶)效果[45],这有利于维持果胶的结构,进而保持胡萝卜的质构。 Chantaro 等[5]研究了漂洗和热空气干燥对胡萝卜皮膳食纤维抗氧化活性的影响,结果显示:经上述处理后的膳食纤维抗氧化能力下降, 其总抗氧化能力由 94.67 下降至 69.92,可能与在热处理过程中胡萝卜中 β-胡萝卜素和酚酸类化合物含量下降有关。
沸水处理对胡萝卜中碳水化合物含量和组成比例影响很大,显著影响水溶性、水不溶性膳食纤维、膳食纤维的溶解性以及葡萄糖含量[46]。 Greve 等[47]通过深入研究发现,在热处理开始阶段,胡萝卜的质构快速软化,之后质构变化速度变缓,在此过程中伴随着水溶性果胶降解, 与细胞壁相连的果胶发生 β-消除反应,拥有低分子质量、CDTA 螯合果胶的胡萝卜软化更加明显。 Sila 等[14]研究了在热处理过程中胡萝卜质构转变和果胶结构变化的相关性, 同样发现前处理时若果胶的甲酯化度显著降低, 则后续的热处理能够获得更好质构的胡萝卜, 这是因为去甲酯化过程中水溶性果胶会转变成水不溶性果胶,使胡萝卜保持相对好的质构。当胡萝卜预先经 400 MPa 高压、60 ℃处理 15 min (同时加入 Ca2+),在相同条件下(100 ℃、12 min),其质构强度大约是未经处理胡萝卜的 7 倍[14]。 胡萝卜预热处理(60 ℃或 70 ℃)时,预先或者同时加入 CaCl2 可起到保持胡萝卜质构的作用,这种效果可 能 与 加 入 CaCl2 降低胡萝卜果胶的酯化度有关[48]。 然而,如果胡萝卜浸煮,即使事先添加了 CaCl2,胡萝卜中总膳食纤维、不溶性膳食纤维和可溶性膳食纤维都有不同程度的下降[49]。 Sila 等[50]通过研究也发现高压能有效防止胡萝卜质构变化,低温漂洗过程(60 ℃、40 min)中加入 Ca2+,对于质构改善帮助更大, 同时再次证实胡萝卜果胶甲酯化度与胡萝卜质构有很强的负相关性, 即当胡萝卜中果胶的甲酯化程度越高, 加工过程中胡萝卜质构变化阻力越小。 其它研究[51-52]也表明,高温、高压处理使得胡萝卜细胞壁上的果胶拥有较小的甲酯化度,延缓在此过程中胡萝卜质构损失。 反之,高温、 低压处理会促使胡萝卜中的水溶性果胶含量增加,CDTA 和 Na2CO3 螯合的果胶含量下降,从而使胡萝卜质构发生软化[52]。 其它研究[47,53]也证实热处理过程中胡萝卜质构变化与果胶的 β-消除反应存在很大关系, 提高温度会加速 β-消除反应, 而事先采用高压预处理则可降低 β-消除反应速率[54]。 加入 Ca2+ 的作用可能也与此部分有关。
上述研究都是利用溶剂萃取法从胡萝卜中获得各种类型的多糖, 研究在热处理过程中多糖结构变化和胡萝卜质构之间的相关性。 有最新研究利用刚果红探针和不同细胞壁多糖特定探针(多聚半乳糖醛酸抗体 JIM7,木聚糖抗体 LM10,木聚糖和阿拉伯木聚糖抗体 LM11, 木葡 聚 糖 抗 体 LM15,甘露聚糖、葡甘露聚糖和半乳甘露聚糖抗体 LM21, 甘露聚糖和葡甘露聚糖抗体 LM22),再结合新型显微技术, 在原位上研究热处理过程中胡萝卜细胞壁的变化,结果显示:胡萝卜中的原有果胶是决定胡萝卜细胞壁多糖分布和细胞壁完整性的主要因素,而热处理会改变这一状况[55]。
热处理也会影响胡萝卜中的胡萝卜素,研究[56] 发现(α-和 β-)胡萝卜素含量在热水处理时这种损失更加明显 (与蒸汽处理相比下降近 50%),然而采用蒸汽处理胡萝卜时, 不溶性膳食纤维中的胡萝卜素下降最为显著, 而水溶性膳食纤维中胡萝卜素增加最多,这种变化趋势可能与胡萝卜素水溶性膳食纤维之间的相互作用有关。 Knockaert 等[57]认为高压力下的加热杀菌和蒸汽灭菌,由于延缓了果胶解聚过程中的 β-消除反应,能够显著提高胡萝卜的质构强度(提高 2.6~4.5 倍),而降低 β-胡萝卜素的生物利用率, 特别是在较为强烈的加热杀菌和蒸汽灭菌条件下。 加工方式和过程对胡萝卜中多糖聚合度的影响往往直接影响胡萝卜汁或者胡萝卜多糖的黏度。Svanberg 等[17]在比较了冻干、漂洗、微波和沸水浸煮等方式对胡萝卜中水溶性膳食纤维的影响后, 发现加工方式和程度对多糖的聚合度和黏度有很大影响, 特别是沸水浸煮的影响最大, 未经处理的胡萝卜水溶性膳食纤维(4%)零剪切速率下的表观黏度为 1.7 Pa·s,而经沸水煮后黏度降到 0.1 Pa·s。胡萝卜可溶性膳食纤维黏度降低影响其营养, 对餐后葡萄糖和胰岛素水平的影响变小[49]。
本文来源于:《中国食品学报》(月刊)创刊于2001年,由中国食品科学技术学会主办。是中国食品科学技术学会的会刊,属中国科技核心期刊和中文核心期刊,刊载内容主要有:食品及食品工业发展相关的原料、配料、工艺、工程、包装、机械、流通、检测、安全、综合利用、新产品等方面的科研成果、试验研究报告、专题研究论文以及国内外食品消费动态、食品科技发展趋势等方面的综述。
除上述加工方式对胡萝卜多糖和质构有影响外,其它一些处理方式也有一定程度的影响。 均质处理会影响胡萝卜多糖含量及其性质,如 Bengtsson 等[58]在研究中发现均质处理(70 bar)对胡萝卜悬浮液细胞团簇大小有较大影响, 对其中的可溶性膳食纤维、可溶性果胶、不可溶性膳食纤维、不可溶性果胶含量影响较小。 采用内切阿拉伯糖水解酶和 B 型 α-L-阿拉伯糖呋喃糖苷酶(α-L-arabinofuranosidase) 对胡萝卜中水溶性果胶去支化后,虽然也能形成胶状结构,但胶的强度变弱,提示长支链结构对于维持胡萝卜“Ca2+ -果胶”凝胶具有重要作用[59]。
5 胡萝卜及其多糖研究前景
纵观胡萝卜和胡萝卜多糖的大量研究报道,发现目前主要集中于食品加工方式对于胡萝卜质构的影响, 而通过分析此过程中多糖相关基本化学成分变化来阐述胡萝卜质构改变的可能原因及两者内在相互关联性, 以及胡萝卜中各种多糖组分精细结构和溶液构象特征的研究报道不多,有关加工方式对其影响的文献更少。 胡萝卜多糖主要为果胶型多糖,其聚合度、甲酯化度、支链结构以及 Ca2+等因素对其黏度有较大影响[16-17,59-60],目前许多相关研究缺乏翔实的物质结构基础信息。
从现有文献来看, 胡萝卜汁通过增加总抗氧化能力,降低脂质过氧化,以保护心血管疾病[61]。本研究团队也发现胡萝卜汁对于改善糖尿病大鼠的相关症状有较大帮助[42],然而作为胡萝卜中主要成分的多糖具体起什么作用尚不清楚。 虽然目前有关胡萝卜膳食多糖功能活性作用报道较少,但有充分证据表明,摄入多糖类膳食纤维,无论是在预防还是改善糖尿病,防治冠心病,预防高血压等方面都有显著效果。 也有少量文献报道了胡萝卜中各类多糖成分可消化性的情况, 而有关胡萝卜多糖对肠道健康的影响, 特别是胡萝卜多糖作用后的肠道菌群变化、 次生代谢产物及其对机体健康影响等方面的研究需要进一步拓展。 此外,果蔬加工过程中品质容易受到影响, 两个最主要考虑对象是结构特征变化和营养价值变化。 从“加工方式对胡萝卜多糖结构和功能的影响” 这一角度深入挖掘胡萝卜及其相关产品的健康效应及其物质作用基础,是今后需要关注的一大研究方向。——论文作者:谢明勇 殷军艺 聂少平
参 考 文 献
[1] 易涛, 郑龙海, 张琳, 等. 胡萝卜属化学成分及药理活性的研究进展[J]. 亚太传统医药, 2009, 5(7): 151-153.
[2] Food Standards Agency. McCance and Widdowson’s the composition of foods[M]. Sixth summary edition. Cambridge: Royal Society of Chemistry, 2002: 262-265.
[3] Chau CF, Chen CH, Lee MH. Comparison of the characteristics, functional properties, and in vitro hypoglycemic effects of various carrot insoluble fiber-rich fractions[J]. LWT-Food Sci Technol, 2004, 37(2): 155-160.
[4] Longstaff M, McNab JM. Digestion of fibre polysaccharides of pea (Pisum sativum) hulls, carrot and cabbage by adult cockerels[J]. Brit J Nutr, 1989, 62(3): 563-577.
[5] Chantaro P, Devahastin S, Chiewchan N. Production of antioxidant high dietary fiber powder from carrot peels[J]. LWT-Food Sci Technol, 2008, 41(10): 1987-1994.
[6] 陈瑞娟, 毕金峰, 陈芹芹, 等. 胡萝卜的营养功能, 加工及其综合利用研究现状[J]. 食品与发酵工业, 2013, 39 (10): 201-206.
[7] Sharma KD, Karki S, Thakur NS, et al. Chemical composition, functional properties and processing of carrot-a review[J]. J Food Sci Tech, 2012, 49(1): 22-32.
[8] Theodosiou M, Laudet V, Schubert M. From carrot to clinic: an overview of the retinoic acid signaling pathway[J]. Cell Mol Life Sci, 2010, 67(9): 1423-1445.
[9] Selja觷sen R, Kristensen HL, Lauridsen C, et al. Quality of carrots as affected by pre- and postharvest factors and processing[J]. J Sci Food Agr, 2013, 93(11): 2611-2626.
[10] Rosales -Mendoza S , Tello -Olea MA. Carrot cells : a pioneering platform for biopharmaceuticals production[ J]. Mol Biotechnol, 2015, 57(3): 219-232.

 >
>