干旱胁迫下AM真菌对矿区土壤改良与玉米生长的影响
时间:
摘要: 以神东矿区塌陷区退化土壤为供试基质,以玉米为宿主植物,研究在干旱胁迫下,丛枝菌根真菌( arbuscular mycorrhizal fungi) 对玉米生长和养分吸收的影响,以及对矿区退化土壤的改良作用。结果表明: 干旱胁迫下,接种 AMF 显著提高了玉米根系侵染率和生物量,玉米叶片相对含水量和叶色值明显高于对照组; 接种组玉米地上部分磷、氮、钙和根系部分磷、钾、钙含量显著增加; 接种 AMF 后,玉米根际土壤总球囊霉素和易提取球囊霉素含量分别增加了 36. 2% 和 33% ,且根际土壤中有机质含量显著增加。由此可见,接种 AMF 促进了玉米对矿质养分的吸收,缓解了干旱造成的玉米生长的不利影响,提高了根际土壤中有机质含量,对矿区退化土壤改良有重要意义。
关键词: 丛枝菌根; 干旱胁迫; 煤矿区; 玉米; 球囊霉素
中国是世界上最大的煤炭生产国和消费国,煤炭是中国最主要的能源,约占一次性能源消费量的 74%[1]。神东矿区是中国目前已探明储量最大的煤田和最主要的煤炭生产基地之一,矿区属典型的半干旱、半沙漠的高原大陆性气候,干旱少雨,水是神东矿区生态环境保护一个重要的限制性因子。中国煤炭开采大约 96% 的为井工开采,4% 的为露天开采。神东矿区主要以井工开采为主,井工开采形成地下采空区,势必会造成地面塌陷[2]。地面塌陷过程中会产生大量裂缝,导致地表水分和养分流失严重[3]。煤炭开采导致矿区水资源流失日益严重,而水是生物体赖以生存的基础,水分的缺失阻碍作物的生长和发育,加剧了矿区农业干旱。研究表明[4],由于水分造成的作物减产超过其他因素导致产量损失的总和。在我国西北地区水分供应不足严重限制了该地区农业发展[5]。因此,对于神东矿区农业生产来说,提高塌陷区农作物对水分的利用率就变的至关重要。
丛枝菌根真菌( AMF) 是一种普遍存在的内共生真菌,它能够与 80% 以上的陆生植物形成共生体[6]。 AMF 在植物群落结构、演替和稳定性方面具有重要的生态学意义[7-9]。随着研究的不断深入,AMF 的作用越来越广泛。AMF 能促进退化土壤上植物的生长和改善土壤的质量[10]; 在营养缺乏条件下,AMF 能显著提高宿主植物对矿质养分的吸收,尤其是磷元素[11-13],据报道,AMF 的根外菌丝可以向植株提供 70% 的磷[14]和 30% 的氮[15]; 在盐胁迫条件,AMF 能缓解胁迫下植物对 P,Ca 和 K 的吸收,缓解盐害和高盐对植物根系的氧化伤害,植入 AMF 能显著提高植物的生物量和出芽率,在改善土壤质量方面也起到积极作用[16-18]; 除此之外,丛枝菌根也能降低其它生物对宿主植物的伤害,提高植物的抗旱性和增加植物的生物量[19-20]。干旱条件下 AMF 能够提高宿主的耐受性,有利于宿主植物对水分的吸收[21-22]。其中,AMF 产生的土壤相关蛋白是土壤的一个重要碳库,同时可以增强土壤团聚体的稳定性,改善土壤质量。
神东矿区位于毛乌素沙地边缘,矿区土壤主要以沙性土壤为主,土壤保水保肥能力差,水分的缺失是矿区退化土壤改良的瓶颈所在,政策上缺乏引导以及经济等因素,目前对矿区退化土壤改良研究较少。本实验室利用 AMF 在煤矿塌陷区土地复垦发现,AMF 能够促进植物吸收矿质养分和水分,提高作物抗逆性和抗病性,改良土壤结构,增强土壤肥力,提高苗木移栽成活率,促进植被恢复[3,23-24]。本研究在结合前人研究的基础上,以西北地区常见农作物玉米为宿主,以矿区退化土壤为基质,模拟神东地区干旱特点,研究 AMF 在干旱胁迫下对玉米养分的调节,同时研究 AMF 对矿区退化土壤的改良效果,为 AMF 应用于干旱状态下西部矿区农业生产提供一定的理论基础,也为 AMF 菌剂的推广奠定技术基础。
1 材料和方法
1. 1 试验材料
供试土壤于 2011 年 4 月采自陕西省神木县李家畔镇活鸡兔矿塌陷区,为沙质退化矿区土,风干,过 1 mm筛。供试土壤基本性状为 pH 值 7. 48; 电导率 35. 4 μs/cm,最大持水量为 22. 86% ; 有机质 6. 07 g /kg; 总氮为 0. 34 g /kg; 全磷 0. 41 g /kg; 有效磷为 7. 2 mg /kg; 速效钾 50 mg /kg; 将供试的土壤在高温灭菌锅里灭菌 1 h,晾干待用。供试玉米种子由中国农业科学院种子公司提供,玉米品种为农大 CFO24。供试菌种为北京市农林科学院植物营养与资源研究所微生物室提供经本实验室增殖培养的内生菌 Glomus mosseae( 简称 G. m) 。
1. 2 试验方法
试验于 2011 年 8 月在中国矿业大学( 北京) 温室内进行,试验分别设干旱加丛枝菌根组( +M) 、干旱不加丛枝菌根组( -M) 、正常供水组( NI) 和正常供水加菌组( NI+M) ,接种量按每 1kg 灭菌后的风干矿区退化沙土加 40g 的菌剂充分混合。栽种玉米的塑料盆规格为: 11cm( 高) ×13cm( 盆口直径) ×9cm( 盆底直径) ,每盆加矿区土量为 1400g,种植玉米前向矿区退化土壤加入 NH4NO3,KH2PO4,K2 SO4 配置营养液作为底肥,使供试土壤中 N、P、K 含量分别为 100 mg /kg,10 mg /kg,150 mg /kg,每个处理 3 个重复,浇水达到最大饱和持水量,水分平衡 1 d 后,播种。将玉米种子用 10% H2O2 溶液浸泡 10min 做表面消毒,在用去离子水清洗 10 次,每个小盆播种玉米 5 棵,玉米出苗 4d 后间苗,每盆保持 2 株,模拟矿区干旱胁迫,浇水量为土壤最大持水量的( 55± 5) % ( 中度干旱) 。利用称重法控制浇水量,使每盆土壤的含水量维持在中度干旱水平,正常供水组每盆土壤含水量维持在最大持水量水平。
1. 3 测定项目和方法
1. 3. 1 玉米生长指标测定
苗期玉米生长到 45d 后,分别收割玉米地上和地下部分,用自来水清洗根系附着的泥土,同时将植物地上部分和根系分开,在100℃烘箱内杀青30min,然后放到70℃烘箱内直至烘干。分别称量每株玉米的地上部分和根系的干质量。
1. 3. 2 叶片相对含水量测定
植物叶片相对含水量 RWC = ( Wf - Wd) /( Wt - Wd) × 100 式中,Wf 为叶片鲜重,Wd 为叶片干重,Wt 为叶片被水充分饱和后的重量。
1. 3. 3 侵染率、菌丝密度和根际土有机质测定方法
玉米收获时,拣出较细的玉米根系,用水清洗干净,剪成 1 cm 长根段,混匀后取鲜根测定菌根侵染率[25]。菌丝密度采用网格交叉法测定[26]。土壤有机质含量的测定采用重铬酸钾外加热法( K2Cr2O7-H2 SO4 法) 。
1. 3. 4 球囊霉素提取和测定方法
球囊霉素是由丛枝菌根真菌分泌的一种含金属离子的糖蛋白,因被非专一性提取而称为球囊霉素相关土壤蛋白( glomalin-related soil protein,GRSP) ,通常定义为 Bradford-反映土壤蛋白,由土壤样中提取出来,分为易提取球囊霉素( easily extractable glomalin,EEG) 和总球囊霉素( total glomalin,TG) ,按照 Wright 及 Janos 的方法稍加修改[27-28]。
( 1) 球囊霉素相关土壤蛋白的提取
易提取球囊霉素相关土壤蛋白的提取方法为: 分别称取土样 1. 00g 于带刻度离心管中,对应加入 8mL 柠檬酸钠浸提剂( 20mmol /L、pH 7. 0) ,加盖,摇匀,在 103kPa、121℃下提取 30min,10000×g 下离心 6min,收集上清液,每个处理重复 4 次。总球囊霉素相关土壤蛋白的提取: 分别秤取土样 1. 00g 于带刻度离心管中,对应加入 8mL 柠檬酸钠浸提剂( 50mmol /L、pH 8. 0) ,加盖,摇匀,在 103kPa、121℃ 下提取 60min,再重复提取 5 次,每次重复提取时,保证提取液体积固定且摇匀土样,使土样与浸提剂充分接触; 每提取一次之后迅速在 10000 ×g 下离心 6min,将上浮物从土壤中分离出去,收集上清液,每个处理重复 4 次。上清液储藏在 4℃ 下直至第 2 天分析。
( 2) 球囊霉素相关蛋白的测定
分别吸取 0. 5mL 的上清液,加入 5mL 考马斯亮蓝 G-250 染色剂( 使用之前过滤) ,加盖,颠倒,显色 10min,于 595nm 波长下比色。用牛血清白蛋白( BSA) 作标准液,考马斯亮蓝法显色,绘制标准曲线,以 1. 00g土壤中蛋白质的微克数表示球囊霉素相关土壤蛋白的含量。
1. 3. 5 玉米 TN、TP、K 和 Ca 的测定
玉米叶片和根系中全氮和全磷含量的测定参考鲍士旦[29]的方法。植物矿质元素离子含量测定,将植物的地上部分和根部的分开,将烘干样品烘干粉碎后,精确称量 0. 5000g,用 HNO3 消煮,定容于 50ml,用 ICPAES( inductively coupled plasma atomic emission spectroscopy,电子感耦合等离子体发射光谱仪) 测定 K+ 、Ca 2+ 含量。
1. 4 数据分析
本研究采用 SAS 统计软件对试验数据进行分析,显著水平设置为 5% 。
2 结果与讨论
2. 1 接种菌根对玉米幼苗生长和根系侵染率的影响
干旱胁迫下,丛枝菌根对玉米干重、根系侵染率和叶片相对含水率都有一定程度的影响 ( 表 1) ,统计分析发现,正常供水条件下,苗期玉米的地上干重和总干重要明显高于不接菌的玉米,且两者的差异性达到显著水平。干旱条件下,菌根对玉米生长促进明显,这可能是菌丝增加了玉米根系与土壤的接触面积,促进了根系对水分和养分的吸收; 接种菌根可显著提高玉米组织的相对含水量,平均每株要比对照组高出 14. 25% ,在组织相对含水量上接菌和不接菌之间表现出明显的差异。同时,接种菌根可显著提高玉米叶片的叶色值 ( SPAD) 且两者之间的差异性达到显著水平。与干旱胁迫组相比,正常供水条件下的玉米生长表现出明显的优势,且差异系显著。正常供水状况下,加菌和不加菌组的玉米在叶片相对含水量和 SPAD 值差异性不显著,但明显要好于干旱胁迫组。综上所述,在外界胁迫条件下,菌根的作用效率为最大,接种丛枝菌根可缓解干旱缺水对苗期玉米生长的影响,有利于玉米生长。
研究发现,干旱胁迫下,丛枝菌根真菌对玉米根系的侵染率可达到 75. 56% ,接种菌根强化了菌根对玉米根系的感染能力,形成互惠互利的共生体。接种菌根菌后玉米根系较高的侵染率也说明本试验所选用的菌根菌剂与玉米之间的选择适应性较好,能够很好地发挥共生体的优势作用。菌丝密度反映了菌根在促进植物生长、营养吸收和抗逆性等方面的能力大小。干旱胁迫下,接种菌根组菌丝密度可达到 4. 05 m /g,表明接种菌根真菌显著地提高植株根外菌丝密度,扩大了根系生存空间和作用范围,更有利于生态的恢复和营养的吸收。在正常供水的条件下,玉米的根系侵染率和菌丝密度仅为 33. 33% 和 2. 36 m /g,明显低于干旱胁迫接菌组。由此可见,干旱胁迫条件下,丛枝菌根真菌更加速对宿主植物玉米侵染,两者更容易形成互惠共生关系。
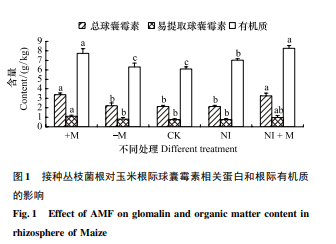
2. 2 接种 AMF 对矿区退化土壤中球囊霉素和有机质影响
球囊霉素( glomalin) 是丛枝菌根真菌产生的一种含有金属离子的专性糖蛋白,难溶于水,难于分解,自然状态下极为稳定[30-31],近期被更名为球囊霉素相关土壤蛋白。它产生于 AMF 定居在宿主植物根内的根内菌丝和伸展在根际土壤中的根外菌丝表面,而且在土壤生态系统中含量不低,因此,它赋予了 AMF 新的生态学功能。本研究发现,接种 AMF 组玉米根际土壤中总球囊霉素含量增加率可达 36. 2% ,两者的差异性达到显 著水平。干旱条件下,接种菌根同时可以提高根际的土壤的易提取球囊霉素的含量,如图 1 所示,接种组易提取球囊霉素增加了 33% 。在总球囊霉素和易提取球囊霉素含量上,-M 组与 CK 相比两者无明显的差异,这说明了球囊霉素相关蛋白是丛枝菌根真菌特有产物。+M 和 NI+M 组在总球囊霉素和易提取球囊霉素含量上差异性不显著,但和其它处理相比,总球囊霉素含量达到显著性水平。+M 组在易提取球囊霉素含量最高,和其它处理相比表现出明显的差异性。
目前认为球囊霉素的主要作用是增加土壤有机碳库和改善土壤团聚体[31-32]。球囊霉素是土壤有机质的主要组成部分,是土壤有机碳、氮的一个重要来源[33],据估计丛枝菌根真菌对土壤生态系统有机碳的贡献为 54—900 kg /hm2[34]。本研究发现( 图 1) ,干旱胁迫下,加丛枝菌根组的有机质含量可达 7. 73g /kg,比未灭菌矿区退化土壤( CK) 有机质含量高出 1. 65 g /kg。由图 1 可见,无论干旱胁迫处理,还是正常供水,接入丛枝菌根真菌都可以提高根际土壤的有机质含量,干旱胁迫加菌组和正常供水加菌组两者无明显差异,但与其它处理相比,表现出明显的差异性。由此可见,接种丛枝菌根有利提高土壤的有机质含量,这可能得益于丛枝菌根真菌提高了退化土壤球囊霉素含量。因此,接种菌根对矿区退化土壤的改良意义显著,这也 Rillig MC 和 Miller RM 的研究结果一致
钙在植物生长和发育中起到至关重要的作用,钙是细胞膜上最重要的物质之一,也是植物收到外界环境胁迫和激素调节的重要信号分子[39]。逆境条件下,钙元素参与启动各种生理生化适应机制[40]。本研究发现 ( 图 5) ,加菌组玉米的地上部钙含量要比对照组高出 22. 2% ; 在钙含量上,玉米根系要表现出相同的规律,加菌组要比对照组高出 16. 8% 。由此可见,干旱胁迫条件下,丛植菌根有利于提高玉米对矿质土壤中钙的吸收 y。
研究发现,干旱胁迫下,玉米植株在氮、磷、钾和钙的含量上都要低于正常供水组和正常供水接菌组,+M 组明显好于-M 组。由此可见,水分是矿区玉米生长的关键因子,接种丛枝菌根可缓解干旱胁迫对玉米的影响,有利于玉米对养分的吸收。因此,对于地处干旱和半干旱的神东矿区,通过接种丛枝菌根真菌,可以缓解干旱对地表植被的影响,同时有利于提高植物对采煤塌陷区退化土壤上养分的吸收。
3 结论
( 1) 干旱条件下,接种 AMF 对苗期玉米生长有明显促进作用,接种 AMF 可显著提高玉米叶片相对含水量和 SPAD 值。同时接种菌根可显著提高根系侵染率和土壤菌丝密度。
( 2) 接种 AMF 提高了根际土壤球囊霉素和有机质含量。接种菌根后,玉米根际土壤总球囊霉素和易提取球囊霉素含量分别增加了 36. 2% 和 33% 。接种菌根组土壤有机质有显著的增加,菌根在提高矿区塌陷区退化土壤肥力上将起到积极作用。
( 3) 接种 AMF 对苗期玉米磷营养改善作用尤为明显,接种 AMF 组的玉米地上部分磷含量要比不接菌组平均高出 0. 17g /kg,而根系部分的磷含量要不接菌组高出 0. 24 g /kg。接种 AMF 显著提高了玉米对 K 和 Ca 的吸收。
( 4) 接种 AMF 可显著提高玉米养分的吸收和促进玉米生长。干旱胁迫条件下,丛枝菌根真菌更易和宿主植物形成互利共生关系。在神东采煤塌陷区,利用 AMF 复垦有利于矿区农业生产,对矿区环境修复和生态恢复具有重要意义。——论文作者:李少朋1 ,毕银丽1,* ,陈昢圳2 ,陈书琳1 ,张延旭1 ,孔维平1 ,王 瑾1
References:
[1] Hu Z Q,Wei Z Y. Existing problems and countermeasures on mining and land reclamation in mine area. Energy Environmental Protection,2003, 17( 3) : 3-7,10-10.
[2] Qian M G,Miao X X,Xu J L. Green mining of coal resources harmonizing with environment. Journal of China Coal Society,2007,32( 1) : 1-7.
[3] Wang S M,Huang Q X,Fan L M,Yang Z Y,Shen T. Study on overburden aquclude and water protection mining regionazation in the ecological fragile mining area. Journal of China Coal Society,2010,35( 1) : 7-14.
[4] Sun J K,Li T,Xia J B,Dong B T. Effects of drought stress on photosynthetic pigment and on root,stem and leaf growth characteristics of elaeagnus angustifolia seedlings. Bulletin of Soil and Water Conservation,2011,31( 1) : 68-71.
[5] Shan L,Chen P Y. Ecological and physiological basis for the Dryland Agriculture. Beijing: Science Press,1999: 159-173.
[6] Smith S E,Read D J. Mycorrhizal Symbiosis. San Diego: Academic Press,1997.
[7] Streitwolf Engel R,Van der Heijden M G A,Wiemken A,Sanders R. The ecological significance of arbuscular mycorrhizal fungal effects on clonal reproduction in plants. Ecology,2001,82( 10) : 2846-2859.
[8] Van der Heijden M G A,Boller T,Wiemken A,Sanders I R. Different arbuscular mycorrhizal fungal species are potential determinants of plant community structure. Ecology,1998,79( 6) : 2082-2091.
[9] Koch A M,Kuhn G,Fontanillas P,Fumagalli L,Goudet J,Sanders I R. High genetic variability and low local diversity in a population of arbuscular mycorrhizal fungi. Proceedings of the National Academy of Sciences of the United States of America,2004,101( 8) : 2369-2374.
[10] Rillig M C,Mummey D L. Mycorrhizas and soil structure. New Phytologist,2006,171( 1) : 41-53.
[11] Chen X,Tang J J,Zhi G Y,Hu S J. Arbuscular mycorrhizal colonization and phosphorus acquisition of plants: effects of coexisting plant species. Applied Soil Ecology,2005,28( 3) : 359-369.


