大葱伴生甜瓜栽培对根际土壤酶活性和细菌群落的影响
时间:
摘 要: 为解决设施栽培土壤恶化引起的甜瓜产量持续下降问题,本研究以大葱与甜瓜进行伴生栽培试验,基于传统土壤农化、土壤酶分析和现代高通量测序技术分析,探究伴生对根际土壤农化、土壤酶、土壤细菌群落结构的影响。结果表明,伴生栽培甜瓜根际土壤细菌数量低于甜瓜单作处理,但差异不显著,而伴生处理的 Shannon 指数显著高于甜瓜单作处理,表明伴生栽培虽然降低了根际土壤细菌数量,却显著提高了细菌群落结构的多样性。细菌结构分析表明变形菌门( Proteobacteria) 等有益菌门是伴生处理中的优势菌门,在播种 80 d 后伴生处理中占比达到 35. 73%; 鞘脂单胞菌属( Sphingomonas) 等有益菌属是伴生处理中的优势菌属,在播种 80 d 后伴生处理中占比达到 11. 90%。通过对土壤农化、土壤酶分析可知,伴生处理中脲酶、蔗糖酶、漆酶等土壤酶活性和速效磷含量均显著高于甜瓜单作; 相关性分析表明,pH 值、速效钾含量、蔗糖酶活性、脲酶活性、漆酶活性和土壤细菌菌落在播种 80 d 后伴生处理中呈显著或极显著相关性。伴生栽培后的甜瓜果实除可溶性固形物含量、果实硬度外,单果重、单株产量以及亩产量均显著高于甜瓜单作。研究表明伴生栽培后土壤的细菌群落得到了改善,这为土壤微生态环境改良提供了理论依据,并为甜瓜生产的可持续发展提供了思路。
关键词: 甜瓜; 伴生栽培; 大葱; 土壤; 细菌
甜瓜( Cucumis melon L.) 是一种高营养价值、高经济价值的作物,近年来成为吉林省夏季日光温室和塑料大棚主栽经济作物之一,然而栽培地未经科学规划、过度利用以及滥用农药、肥料等[1],导致甜瓜根际土壤的微生态环境恶化,严重影响了甜瓜的生长发育,使甜瓜品质下降并且大幅减产。因此,当务之急是解决甜瓜生产困境。目前,基于绿色、可持续发展的理念,在生产上常利用化感作用进行不同植物间栽培,以期达到绿色有机生产的目的。伴生栽培是在园艺生产中常见的一种以收获主栽作物为目的的特殊间作模式。
伴生栽培是将 2 种或 2 种以上生长季节相近或相似的作物按一定比例分行或分带种植在同一田地上的一种精耕细作、集约化种植的传统技术[2-3]。夏秀波等[4]研究证明大葱伴生能够促进番茄植株生长,延缓叶片衰老; 有研究证明分蘖洋葱伴生能够提高番茄根际土壤微生物的多样性,并且能够增强植株的抗病能力[5-6]。葱蒜类蔬菜因具有独特的抑菌特性和田间土壤生态环境改良效应,现已受到越来越多的重视,目前对葱蒜类蔬菜的开发和利用也逐渐走向多元化。通过近 年 针 对 大 蒜 ( Allium sativum L.) [7-8]、分 蘖 洋 葱 ( Allium cepa L.) [9-10]和大葱( Allium fistulosum L.) [4]缓解土壤连作障碍的研究发现,主栽作物分别与这 3 种作物轮作、间作、套作、伴生、填闲等栽培方式,不仅可以增加地上部的物种多样性[11],而且可以通过根系分泌物对土壤微生态环境起到调控作用,进而抑制病原微生物的生长[12],促进幼苗植株生长。
土壤微生态环境的变化情况直观反映了伴生栽培的作用。微生物能对土壤中的生物残体[13]及有机物进行转化、水解,同时对土壤养分的增加有促进作用,是土壤中最活跃的部分之一[14]。研究表明微生物群落结构的组成是反映土壤中物质代谢旺盛程度的重要指标之一[15]。细菌是构成土壤微生物的主要生物量之一,占整个土壤微生物群落的 70% ~ 90%,并且在维护土壤健康、拮抗土传病害等方面做出了积极贡献[16]。细菌在土壤中发挥的重要作用直接体现在土壤的肥力状况上[17],并最终影响植物的生长[18]。土壤微生物数量和群落结构[19]等方面的初期研究大多采用的较早的生物技术,如变性梯度凝胶电泳( pcrdenaturing gradient gel electrophoresis,PCR-DGGE) 技术[19]、Biology 技术[20],仅能检测土壤微生物的优势菌落,而无法检出组成占比低的微生物。随着现代高通量测序技术的推广及应用,土壤微生物中的优势物种、稀有物种及部分未知物种都可以被检测出来[21]。为此,本试验基于土壤农化性质测定、土壤酶测定、高通量测序方法,分析大葱伴生栽培对甜瓜根际土壤中细菌群落结构阶段变化的影响,综合评价根际土壤农化、酶活性与土壤细菌群落结构的互作效应,并通过后期对甜瓜果实进行测产来验证伴生栽培的效果,以期为建立适合甜瓜持续适效的栽培模式提供理论基础。
1 材料与方法
1. 1 试验材料与试验地概况
供试材料薄皮甜瓜品种为景路甜蜜王,大葱品种为普威长夏,均购自吉林省长春市种子市场。试验于 2020 年 6 月至 12 月在吉林农业大学园艺学院蔬菜生产基地( 125°27'E,43°46'N) 进行,栽培土壤类型是黑壤土,其养分性状: pH 值 7. 02,有机质 58. 35 g·kg-1 ,碱解氮 99. 47 mg·kg-1 ,速效磷 201. 24 mg·kg-1 ,速效钾 701. 25 mg·kg-1 。
1. 2 试验设计
试验设 4 个处理,分别记作 DZ1、BS1、DZ3、BS3,详见表 1。于 2020 年 6 月 18 日,将温室原土和商品鸡粪按 9 ∶ 1 的比例搅拌均匀装盆,然后将 5 株株高 20 cm 的葱沿着 26 cm×21 cm 营养钵的边缘均匀地移栽到盆中。6 月 20 日直播甜瓜种子于营养钵的中心位置,每盆 3 粒。营养钵按照 45 cm× 90 cm 的株行距半埋在温室内。在甜瓜两叶一心时进行间苗,选留一株健壮秧苗,5 ~ 6 片真叶时去掉主蔓生长点,选留两条长势一致的子蔓,抹掉孙蔓侧芽,吊蔓栽培,分别在第 7 和第 15 节留瓜,每条子蔓留两瓜,每株四瓜,待子蔓生长至 20 片叶时摘心,常规田间管理。栽培期间追肥一次,在果膨大期随水施入磷钾复合肥,施入量为每盆 12 g。本试验每个处理设置 30 盆,4 个处理共 120 盆。
1. 3 测定项目与方法
1. 3. 1 产量及果实品质测定 在 2020 年 9 月 18 日 ( 播种 90 d 后) 采收甜瓜果实。甜瓜果实硬度采用 FT -327 水果硬度计( 北京金科利达电子科技有限公司) 测定; 可溶性固形物采用 MHY-22747 手持式糖量计 ( 北京美华仪科技有限公司) 测定; 根据平均单果重、单株结瓜数和栽培密度统计单株产量和亩产。
1. 3. 2 土壤性质测定 分别于 2020 年 7 月 30 日( 播种 40 d 后) 和 2020 年 9 月 8 日( 播种 80 d 后) 采用抖根法[22]采集土样,每个处理随机选取 5 盆,取土壤表层下 15 cm 的土样,约 200 g。样品采集后仔细去除新鲜土样中可见的植物残体及其他杂质,将其中部分土放入无菌离心管中,置于液氮内速冻,然后置于-80℃ 超低温冰箱中保存,用于土壤细菌群落结构分析; 另一部分土壤样品经自然风干后过 100 目筛,用作测定土壤农化理化及土壤酶活性。
土壤农化性质测定参照《土壤农化分析》[23]。土壤 pH 值采用 F-74 酸度计( 日本 HORIBA) 测定; 土壤有机质含量采用重铬酸钾消煮容量法测定; 土壤碱解氮含量采用碱解扩散法测定; 土壤速效磷含量采用钼锑抗比色法测定; 土壤速效钾含量采用火焰光度法测定。
土壤酶活性测定参照《土壤酶及其研究法》[24]。土壤脲酶活性采用靛酚蓝比色法测定; 土壤酸性磷酸酶活性采用磷酸苯二钠比色法测定; 土壤蔗糖酶活性采用 3,5-二硝基水杨酸比色法测定; 土壤过氧化氢酶活性采用比色法测定。土壤漆酶活性采用活性光度法测定[25]。
土壤细菌群落检测土样送于诺禾生物科技有限公司并基于高通量测序技术完成细菌群落结构分析。利用诺禾生物科技公司提供的 Novomagic 云数据分析平台进行根际土壤细菌多样性分析,构建物种组成群落图。
1. 4 数据分析
试验数据采用 Microsoft Excel 2016 软件进行处理,数据的多重比较使用 DPS 数据处理系统。
2 结果与分析
2. 1 伴生对甜瓜果实产量及品质的影响
伴生对甜瓜果实品质和产量的影响见表 2。伴生处理与单作处理的甜瓜果实可溶性固形物含量、果实硬度均无显著差异; 伴生处理的单果重、单株产量以及亩产均显著高于单作处理,伴生处理单果重和亩产分别较单作增加 13. 1%和 12. 7%。整体来看,伴生栽培可以促进甜瓜生长,进而增加单果重及产量。
2. 2 伴生对根际土壤农化性质及土壤酶活性的影响
由表 3 可知,播种 40 d 后,伴生处理土壤的 pH 值、有机质含量、碱解氮含量、速效钾含量均低于单作处理,速效磷含量高于单作处理; 另外,伴生处理的土壤脲酶、酸性磷酸酶、蔗糖酶、过氧化氢酶、漆酶活性均高于单作处理,其中脲酶和漆酶活性差异达显著水平。播种 80 d 后,伴生处理的土壤 pH 值、有机质、速效磷含量高于单作处理,其中速效磷含量显著高于单作处理,而碱解氮、速效钾含量则显著低于单作处理; 此外,伴生处理的土壤脲酶、酸性磷酸酶、蔗糖酶、漆酶活性均显著高于单作处理。
2. 3 伴生对根际土壤细菌群落结构的影响
2. 3. 1 根际土壤细菌多样性分析 伴生对根际土壤细菌多样性的影响见表 4。随着栽培时间的延长,伴生处理土壤细菌的 Ace 指数、Chao1 指数、Shannon 指数整体呈降低趋势。播种 80 d 后伴生处理的 Shannon 指数显著小于播种 40 d 后的单作和伴生处理,表明大葱伴生显著减少了根际土壤细菌的数量,另外播种 80 d 后伴生处理的 Simpson 指数在所有处理中最低,表明伴生后期土壤细菌多样性增加。本次测序各样本文库的覆盖率均达 98%以上,结果可以代表样本中微生物的真实情况。
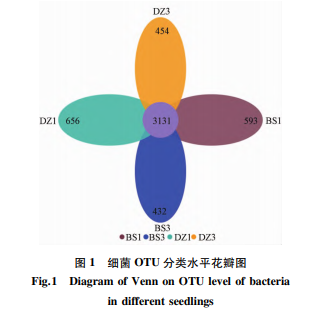
花瓣图主要用于统计多个样本中所共有和独有的可操作性分类单元( operational taxonanic units,OTU) 数量。由图 1 可知,播种 40 d 后伴生处理和单作处理根际土壤中特有的细菌 OUT 数量是 593、656,总 OUT 数量是 3 724、3 787; 播种 80 d 后伴生处理、单作处理特有的细菌 OUT 数量是 432、454,总 OUT 数量是 3 563、3 585。共有的细菌 OUT 数量为 3 131。
2. 3. 2 根际土壤细菌 OTU 水平的主成分分析 图 2 是从测序结果中提取出主成分( 最主要的元素和结构) ,通过一系列特征值和特征向量排序进行的主坐标分析( principal co-ordinates analysis,PCoA) 。样品距离越接近,表示物种组成结构越相似。由图 2 可知,第一主成分对样品差异的贡献率为 36. 63%,第二主成分对样品差异的贡献率为 24. 51%。每个样品的群落结构相似度较高,样品倾向于聚集在一起,播种 80 d 后伴生处理的土壤样本与其他样本菌落组成结构差异最大,且其细菌菌落组成结构差异最小。因此,播种 80 d 后伴生处理对土壤细菌群落组成有显著正相关影响。
2. 3. 3 根际土壤细菌结构分析 图 3 展示了 4 个根际土壤样本中门水平细菌群落结构。结果表明,4 个根际土壤样本中共有的主要细菌门有 12 个,其中变形菌门 ( Proteobacteria ) 占 比 最 高,分 别 是 33. 07%、 34. 25%、32. 31%、35. 73%,而且播种 40 和 80 d 后单作处理土壤样本的变形菌门、未名菌门( unidentified_ Bacteria) 、酸杆菌门( Acidobacterio) 相对丰度均大于 10%,播种 40 和 80 d 后伴生处理土壤样本中只有变形菌门和未名菌门的相对丰度大于 10%。
图 4 展示了 4 个根际土壤样本中属水平细菌群落结构。结果表明,4 个根际土壤样本中共有的主要细菌属有 11 个,包括鞘脂单胞菌属( Sphingomonas) 、拉尔斯顿菌属 ( Ralstonia) 、RB41、MND1、芽孢杆菌属 ( Bacillus) 、芽 单 胞 菌 属 ( Gemmatimonas ) 、杆 菌 属 ( Bryobacter) 、类固醇杆菌( Steroidobacter) 、盖埃拉菌属 ( Gaiella) 、黄 杆 菌 属 ( Flavisolibacter) 、哈 良 草 菌 属 ( Haliangium) ,而且播种 80 d 后伴生处理的土壤样本中鞘脂单胞菌属( Sphingomonas) 的占比达到 11. 90%,高于其他 3 个土壤样本。
2. 3. 4 根际土壤细菌菌落与土壤农化性质、土壤酶活性的 相 关 关 系 由 图 5 可 知,鞘 脂 单 胞 菌 属 ( Sphingomonas) 与漆酶和脲酶活性呈显著正相关,与速效 钾 含 量 呈 极 显 著 负 相 关; 拉 尔 斯 顿 菌 属 ( Ralstonia) 和速效钾含量呈显著正相关; RB41 与漆酶、脲酶、蔗糖酶活性呈显著负相关; 芽孢杆菌属 ( Bacillus) 和速效钾含量呈极显著正相关; 芽单胞菌属 ( Gemmatimonas) 和速效钾含量呈极显著负相关、杆菌属( Bryobacter) 与 pH 值、速效钾含量呈显著正相关; 类固醇杆菌( Steroidobacter) 和速效钾含量呈极显著正相关; 盖埃拉菌属( Gaiella) 和速效钾含量呈显著正相关。
3 讨论
与单作处理相比,伴生后根际土壤中有机质、碱解氮、速效钾含量均呈降低趋势,且随着伴生时间的延长,降低程度变缓,降低的原因可能是伴生大葱与甜瓜竞争养分,后期出现变缓趋势可能是通过伴生促进了土壤中原有养分的释放,使土壤中的养分达到平衡状态,这与赵晓翠[3] 在甘蓝伴生黄瓜研究中的结论相似。另外,在本研究中,接种 80 d 后伴生处理土壤中脲酶、酸性磷酸酶、蔗糖酶和漆酶活性总体显著高于单作,表明伴生栽培后显著提高了土壤酶活性,原因可能是通过伴生栽培造成了微生物互作,继而活化了根际微生物的生命活动,进而提高了土壤酶活性,改变了土壤的养分含量,这与孟亚利等[26]在棉麦共生研究中的结果大致相符。但关于根际土壤中各项理化指标和各类酶活性与植物体内的养分传送和转导、植物生理生化状况的具体关联还有待进一步研究。
土壤微生物群落结构多样性在维持生态系统功能上有着重要作用[27]。本研究结果表明,大葱伴生栽培后减少甜瓜根际土壤细菌数量,这与夏秀波等[28]在大葱伴生黄瓜上的研究结果相似; 另外伴生栽培后增加了土壤细菌多样性,改变了甜瓜根际土壤细菌群落结构。在细菌门水平上,变形菌门占比最高,并且伴生处理变形菌门的相对丰度高于单作处理。Liu 等[29]发现变形菌门与有机质含量呈显著或极显著正相关,这与本研究结果趋势大致相符,伴生栽培后期由于变形菌门丰度增加促进了土壤有机质含量的少量增加。酸杆菌门具有嗜酸性,其丰度受 pH 值影响[30],土壤 pH 值降低有利于其生长[31],因此伴生栽培后酸杆菌门丰度增加。在细菌属水平上,鞘脂单胞菌属为 4 个根际土壤样本的共同优势菌群。鞘脂单胞菌属是一类丰富的新型细菌资源,可用于芳香化合物的生物降解[32],进一步研究表明该菌属在农业中也有广泛应用[33],对有机磷、氨基甲酸酯、五氯苯酚和除虫菊酯[34]等三类农药具有较好的降解能力,同时对其他一些农药的降解也有良好效果[35]。鞘脂单胞菌属作为一种有益菌属,在解决甜瓜栽培地农药残留方面起到了积极作用。另有研究发现旱地中有机磷微生物主要是芽孢杆菌属[36]。本研究中伴生栽培后增加了芽孢杆菌属丰度,从而使根际土壤中速效磷含量提高,这与林启美等[37]研究结果相符。正是由于这些有益菌属的丰度增加改良了土壤生态环境。
通过对甜瓜测产得出伴生栽培后甜瓜单果重比单作栽培增加 13. 10%,推算得出亩产增加 12. 70%。这与前人研究结果一致,徐蕾[38]发现大葱套作白菜的白菜鲜重较单作增加了 35. 71%; 夏秀波等[4]在大葱伴生番茄栽培试验中,大葱伴生番茄处理较番茄单作增产 8. 30%; 李培颖等[39]在小麦伴生栽培黄瓜中,伴生处理产量比单作提高了 4. 7%。伴生处理后,甜瓜产量增加可以佐证大葱伴生栽培甜瓜模式是有效的、可供推广的栽培模式。
4 结论
本研究以大葱伴生栽培甜瓜后,对伴生栽培土壤的农化性质、土壤酶活性和高通量测序结果分析,得出伴生后土壤农化性质改变、土壤酶活性增加、土壤中有益菌丰度增加,进而增加甜瓜产量。接种 80 d 后大葱伴生栽培土壤的 pH 值、有机质含量高于单作,速效磷含量显著高于单作; 脲酶、蔗糖酶、漆酶等土壤酶活性均 显 著 高 于 单 作; 在 门 水 平 上 变 形 菌 门 ( Proteobacteria) 等有益细菌门相对丰度增加; 在属水平上 鞘 脂 单 胞 菌 属 ( Sphingomonas) 、芽 孢 杆 菌 属 ( Bacillus) 等有益菌属相对丰度增加; 相关性分析表明,土壤细菌与土壤脲酶、土壤漆酶活性、pH 值、速效钾含量有显著相关性。表明大葱伴生栽培甜瓜模式为解决甜瓜根际土壤的微生态环境恶化导致的大幅减产问题提供了参考。——论文作者:倪 栋1 陈应素1 李 爽2 汤雨凡1 刘翔毓3 殷 乐4 周艳丽1,*
参考文献:
[1] 卢维宏,张乃明,包立,张丽,秦太峰. 我国设施栽培连作障碍特征与成因及防治措施的研究进展[J]. 土壤,2020,52( 4) : 651-658
[2] 刘巽浩.中国耕作制度[M]. 北京: 农业出版社,1993: 63-75
[3] 赵晓翠. 伴生栽培对黄瓜根区土壤环境的影响[D]. 泰安: 山东农业大学,2016
[4] 夏秀波,李涛,姚建刚,曹守军,王虹云,张丽莉. 大葱伴生栽培对日光温室连作番茄生长、产量和光合特性的影响[J]. 长江蔬菜,2015( 2) : 43-46
[5] 付彦祥,李乃荟,刘佳遥,吴凤芝. 伴生分蘖洋葱对番茄根际微生物群落结构的影响[J]. 中国蔬菜,2020( 6) : 49-57
[6] 吴瑕,杨凤军,张文慧,靳亚忠,高凤,吴凤芝. 间作对分蘖洋葱与番茄根际土壤磷转化强度及磷细菌群落结构的影响[J].植物营养与肥料学报,2019,25( 8) : 1422-1433
[7] 王梦怡. 连续套作大蒜对大棚连作茄子的生物效应和生态效应研究[D]. 杨凌: 西北农林科技大学,2016
[8] 程芳. 大蒜化感物质二烯丙基二硫( DADS) 对番茄的化感效应和消减连作障碍机制[D]. 杨凌: 西北农林科技大学,2017
[9] 白晶芝,于洪杰,安冬梅,吴凤芝. 不同分蘖洋葱品种伴生对番茄生长及根结线虫的影响[J]. 北方园艺,2018( 18) : 1-8
[10] 王旋旋,田罡铭,吴凤芝. 分蘖洋葱伴生减磷对番茄生长发育及光合指标的影响[J]. 中国蔬菜,2018( 10) : 46-49
[11] 胡国彬,董坤,董艳,郑毅,汤利,李欣然,刘一鸣. 间作缓解蚕豆连作障碍的根际微生态效应[J]. 生态学报,2016,36( 4) : 1010-1020
[12] Dai C C,Chen Y,Wang X X,Li P D. Effects of intercropping of peanut with the medicinal plant Atractylodes lancea on soil microecology and peanut yield in subtropical China[J]. Agroforestry Systems,2013,87( 2) : 417-426

 >
>