多糖疫苗中十六烷基三甲基溴化铵和去氧胆酸残留量液相色谱串联质谱检测方法的建立及验证
时间:
摘要:目的建立多糖疫苗中十六烷基三甲基溴化铵(hexadecyltrimethylammoniumbromide,CTAB)和去氧胆酸(deoxycholicacid,OBA)残留量的液相色谱串联质谱(liquidchromatographytandemmassspectrometry,LC-MS/MS)检测方法,并进行验证。方法建立以Kinetex色谱柱C18(2.1mm×50mm,2.6μm)为固定相,5mmol/L甲酸铵、乙腈为流动相的LC-MS/MS法,并验证方法的线性范围、精密性、准确度、检出限及定量限。采用建立的方法检测23批肺炎球菌多糖(1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17A、18C、19A、19F、20、22F、23F和33F)、3批b型流感嗜血杆菌(Haemophilusinfluenzaetypeb,Hib)粗糖和精糖、3批A、C、Y、W135群脑膜炎球菌粗糖和精糖中CTAB及OBA残留量。结果CTAB浓度在1.56~50μg/L范围时,与峰面积呈良好的线性关系,回归方程为Y=133056X-29015,R2=0.9999;OBA浓度在6.25~100μg/L范围时,与峰面积呈良好的线性关系,回归方程为Y=250.5X-59.1,R2=0.9997;OBA及CTAB对照品6次重复进样检测的保留时间和峰面积RSD均<2%;OBA和CTAB加标回收率均在91.8%~103.5%之间;OBA的检出限为1.02μg/L,定量限为2.04μg/L,CTAB的定量限为1.56μg/L。4、9N、9V和15B型肺炎球菌多糖无明显CTAB检出,其他血清型均有不同程度检出;大部分血清型肺炎球菌多糖中无明显OBA检出。3批A、C、Y、W135脑膜炎球菌粗糖中CTAB残留量为112.40~1709.60μg/L,对应批次精糖中CTAB残留量为0.08~43.20μg/L。3批Hib粗糖中CTAB残留量分别为1265.10、1189.00和1513.30μg/L,对应批次精糖中CTAB残留量分别为6.50、166.60、6.65μg/L。结论建立了多糖疫苗中CTAB和OBA的LC-MS/MS检测方法,该方法具有良好的精密性及准确度,可用于多糖疫苗及多糖结合疫苗中CTAB和OBA残留量的检测。
关键词:液相色谱串联质谱;十六烷基三甲基溴化铵;去氧胆酸;肺炎球菌多糖;脑膜炎球菌多糖;b型流感嗜血杆菌荚膜多糖
多糖疫苗是疫苗重要类型之一[1],如23价肺炎球菌多糖疫苗(23-valentpneumococcalpolysaccharidevaccine,PPSV-23)[2]。PPSV-23自上市以来,广泛用于2岁以上人群的免疫,在预防肺炎球菌感染中发挥了重要作用,尤其对老年人和艾滋病患者[3],PPSV23是全球排名前十的高销量疫苗品种之一。同时,多糖疫苗也是多糖蛋白结合疫苗的基础,如脑膜炎球菌结合疫苗[4-5]和b型流感嗜血杆菌(Haemophilusinfluenzaetypeb,Hib)结合疫苗[6]。多糖疫苗和多糖蛋白结合疫苗中的多糖生产过程相似[7],去氧胆酸(deoxycholicacid,OBA)用于PPSV-23收获液的杀菌,脑膜炎球菌多糖疫苗生产无需该试剂,但大部分多糖疫苗和多糖蛋白结合疫苗均以十六烷基三甲基溴化铵(hexadecyltrimethylammoniumbromide,CTAB)作为多糖纯化剂。
OBA和CTAB均为弱紫外(无紫外)吸收,未经衍生难以用紫外/可见光检测和定量。疫苗基质复杂,紫外/可见光检测受基质干扰较大,灵敏度和重复性受到较大限制。通用型检测器可用于弱紫外化合物的直接检测[8-9],无须衍生,但该类检测器灵敏度较低且受基质干扰较大,不适合疫苗基质中微量残留物质的检测。GIRARD等[10]研发了一种固相萃取-液相色谱方法用于流感疫苗中OBA的检测,但该方法灵敏度较低,前处理过于繁琐,不利于普及。《中国药典》三部(2020版)采用衍生-紫外分光光度法检测残留的OBA[11],但该方法无分离选择性、易受基质干扰,且灵敏度较低。目前未见CTAB的检测方法相关报道。液相色谱串联质谱(liquidchromatographytandemmassspectrometry,LC-MS/MS)法兼具LC的分离能力及前体离子与产物离子双重选择性(MRM模式),可提高检测的准确度和抗基质干扰能力,适用于快速检测[2,12-13]。魏瑞成等[14]采用固相萃取-LCMS/MS法成功定量检测出牛奶中残留的CTAB。为了解多糖疫苗中CTAB和OBA的残留情况,本研究建立采用液相分离及MRM模式的LC-MS/MS方法,并进行方法的验证,以期用于多糖疫苗中OBA和CTAB残留量的检测。
1材料与方法
1.1对照品及样品CTAB(57-09-0)和OBA(83-44-3)对照品购自美国Sigma公司;肺炎球菌多糖(1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17A、18C、19A、19F、20、22F、23F和33F型)、3批Hib粗糖及其对应批次精糖、3批A、C、Y、W135群脑膜炎球菌粗糖及其对应批次精糖均由中国食品药品检定研究院提供,其中脑膜炎球菌多糖溶液和Hib多糖溶液含糖量为5g/L。
1.2主要试剂及仪器甲酸铵(MS级)及甲酸(MS级)购自美国Acros公司;乙腈(HPLC级)购自美国默克公司;三氟乙酸购自美国Sigma公司;KinetexC18(2.1mm×50mm,2.6μm)色谱柱购自美国菲罗门公司;液相色谱质谱系统购自日本岛津公司。
1.3方法的建立
1.3.1色谱条件色谱柱为KinetexC18(2.1mm×50mm,2.6μm)。流动相A:5mmol/L甲酸铵(pH4.0);流动相B:乙腈,梯度:0~1.0min40%B,1.0~3.0min90%B,3.0~4.0min90%B,4.0~4.1min90%~40%B,4.1~6.0min40%B;柱温:35℃;流速:0.3mL/min;进样体积:2μL;进样清洗:泵清洗(进样前后清洗),洗针方式为清洗口+清洗泵(针内外清洗),先清洗泵,后清洗口。清洗口清洗液:R0为50%甲醇水,R1为0.1%甲酸水溶液,R2为100mmol/L甲酸铵水溶液(pH4);清洗泵清洗液R3为甲醇、乙腈、乙醇、异丙醇、水、三氟乙酸的混合液(体积比200∶200∶200∶200∶200∶5)。
相关知识推荐:药物生物技术怎么投稿容易
1.3.2质谱条件离子源:ESI,正负离子同时检测模式;雾化气流速:3.0L/min;干燥气流速:10L/min;驻留时间:30ms;接口温度:300℃;DL温度:220℃;接口电压:4.0kV;MRM参数:CTAB检测离子(m/z)为284.3→60.1,Q1PreBias-15V,CE-29V,Q3PreBias-24V;OBA检测离子(m/z)为391.3→345.2和391.3→327.1,Q1PreBias均为15V,CE分别为33和35V,Q3PreBias分别为22和20V,其中391.3→345.2为定量离子。
1.4方法的验证
分别称取CTAB和OBA对照品10mg,用50%乙腈水溶液配制成10mg/L的对照品母液。
1.4.1线性范围用50%乙腈水溶液将CTAB对照品母液配制成浓度为50、25、12.5、6.25、3.13、1.56μg/L的对照品溶液,将OBA对照品母液配制成浓度为100、50、25、12.5、6.25μg/L的对照品溶液,采用1.3项色谱及质谱条件进行检测。以对照品溶液浓度为横坐标,峰面积为纵坐标绘制标准曲线,获得回归方程,并计算R2值。
1.4.2精密性用50%乙腈水溶液分别将CTAB及OBA对照品母液稀释为1.593和1.56μg/L的对照品溶液,采用1.3项色谱及质谱条件进行检测,重复进样6次,计算出峰时间及峰面积的相对标准偏差(RSD)。
1.4.3准确度分别取CTAB及OBA对照品母液100μL,用50%乙腈水溶液稀释至1mL(对照);分别取900μL肺炎球菌多糖(1、3、4、5、6B和19A型)、脑膜炎球菌精糖(A、C群)及Hib精糖,加入100μL50%乙腈水(样品);分别取900μL上述样品,加入至100μL对照品母液中(加标样品),采用1.3项色谱及质谱条件进行检测,并按下式计算回收率。回收率(%)=(加标样品-样品)/对照×100%
1.4.4检出限及定量限参照ASTM法原则,即检出限浓度目标化合物S/N不小于3,定量限浓度目标化合物S/N不小于10的原则确定方法的检出限及定量限。分别取CTAB及OBA对照品母液,用50%乙腈水稀释至1~2μg/L,采用1.3项色谱及质谱条件进行检测。
1.5方法的应用取23批肺炎球菌多糖(1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17A、18C、19A、19F、20、22F、23F和33F型)、3批Hib粗糖和精糖、3批A、C、Y、W135群脑膜炎球菌粗糖和精糖,用50%乙腈水溶液稀释2~300倍,采用1.3项色谱及质谱条件检测CTAB及OBA残留量。
2结果
2.1方法的验证
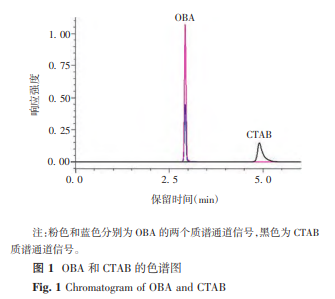
2.1.1线性范围CTAB和OBA典型色谱质谱图见图1,标准曲线见图2。CTAB浓度在1.56~50μg/L范围时,与峰面积呈良好的线性关系,回归方程为Y=133056X-29015,R2=0.9999;OBA浓度在6.25~100μg/L范围时,与峰面积呈良好的线性关系,回归方程为Y=250.5X-59.1,R2=0.9997。
2.1.2精密性OBA对照品溶液6次重复进样检测的保留时间和峰面积的RSD分别为0.15%和1.42%,CTAB对照品溶液6次重复进样检测的保留时间和峰面积RSD分别为0.16%和1.50%,均<2%,见表1。表明该方法具有良好的精密性。
2.1.3准确度OBA和CTAB加标回收率在91.8%~103.5%之间,均在80%~115%范围内,见表2。表明该方法具有良好的准确度。
2.1.4定量限及检出限OBA的检出限为1.02μg/L(S/N=5.6),定量限为2.04μg/L(S/N=10.2);CTAB的定量限为1.56μg/L(S/N=77.4)。
2.2方法的应用
2.2.1肺炎球菌多糖4、9N、9V和15B型肺炎球菌多糖无明显CTAB检出,其他血清型均有不同程度检出。与CTAB比较,OBA的残留较少,甚至大部分血清型的肺炎球菌多糖中无明显OBA检出。见图3(以19A和23F型为例)和表3。
2.2.2脑膜炎球菌多糖3批A、C、Y、W135脑膜炎球菌粗糖中CTAB残留量为112.40~1709.60μg/L,对应批次精糖中CTAB残留量为0.08~43.20μg/L,见表4。
2.2.3Hib多糖3批Hib粗糖中CTAB残留量分别为1265.10、1189.00和1513.30μg/L,对应批次粗糖中CTAB残留量分别为6.50、166.60、6.65μg/L。
3讨论
本研究建立了用于同时定量测定CTAB和OBA的快速、高选择性和高灵敏度的LC-MS/MS方法,前期预实验确定OBA检测离子(m/z)为391.3→345.2和391.3→327.1,CTAB检测离子(m/z)为284.3→60.1,该结果与文献报道相符[14]。CTAB等季胺型表面活性剂极易在系统中残留,导致测试结果出现偏差,前期预实验确定CTAB最易残留的位置为进样系统。因此,本实验采用清洗泵+清洗口的清洗方式进行清洗,该方式可利用清洗泵清洗液的强清洗能力去除残留的三氟乙酸消除洗针液对OBA检测的影响。
本研究线性验证结果表明,CTAB浓度在1.56~50μg/L范围内与峰面积呈良好的线性关系,回归方程为Y=133056X-29015,R2=0.9999;OBA浓度在6.25~100μg/L范围内与峰面积呈良好的线性关系,回归方程为Y=250.5X-59.1,R2=0.9997。OBA及CTAB对照品6次重复进样检测的保留时间和峰面积RSD均<2%,表明该方法具有良好的精密性。OBA和CTAB加标回收率均在80%~115%范围内,表明该方法具有良好的准确度。准确度验证中采用的样品分别为肺炎球菌多糖1、3、4、5、6B和19A型,涵盖了弱酸性多糖(含有羧基,1型-三分之二糖单元含羧基、3型-二分之一糖单元含羧基、4型-四分之一糖单元含羧基、5型-五分之一糖单元含羧基)和中强酸性多糖(含有磷酸基团,6B型-四分之一糖单元含磷酸基团、19A型-三分之一糖单元含磷酸基团),用这些典型的样品代替全部样品进行验证。OBA的检出限为1.02μg/L,定量限为2.04μg/L;受CTAB残留影响,无法测试CTAB的检出限和定量限,本研究以不干扰CTAB线性测试的最低浓度1.56μg/L作为CTAB的方法定量限。采用低残留进样系统和独特的洗针方式后,CTAB的残留较小,与已报道的LC-MS/MS定量法比较[15],灵敏度有所提升,且无需复杂前处理步骤。
肺炎球菌多糖中OBA和CTAB定量检测结果显示,除4、9N、9V和15B型多糖无明显CTAB检出外,其他型别均有不同程度检出,其中3型肺炎球菌多糖CTAB的含量高达12.1mg/L。不同血清型多糖纯化工艺中CTAB的添加量及后续纯化步骤的差异均会导致最终CTAB残留量的不同。从结构分析,3型多糖疫苗中50%以上糖单元含有羧基,4、9N、9V和15B型多糖疫苗结构中,负电荷基团所占比例均较低(摩尔比为1/4~1/5)。负电荷基团(如羧基)越多表明与CTAB的结合率越高,可能是导致不同血清型多糖疫苗中CTAB残留量不同的原因之一。另外,CTAB易在系统中残留,若使用CTAB进行纯化多糖的容器清洗不充分,该容器在承装其他不采用CTAB纯化的多糖时,可能会造成CTAB污染。本实验中肺炎球菌多糖除3型以外,其他多糖未采用CTAB纯化,但在多种多糖中均有不同程度CTAB检出,推测可能由于容器去除CTAB不彻底所致。与CTAB比较,OBA的残留较少,甚至大部分血清型的多糖疫苗中无明显OBA检出。其原因可能为:OBA的添加量较少;OBA在多糖疫苗工艺中最早添加(培养终止时即已添加),后续纯化工艺中添加的试剂(如CTAB、乙醇和丙酮)均可去除残留的OBA。脑膜炎球菌粗糖样品中,同血清型样品的残留CTAB含量差异可反应纯化工艺的差异和批间稳定性,3批脑膜炎球菌粗糖和对应批次精糖均有不同程度的CTAB检出。与粗糖比较,各血清型精糖样品中CTAB的含量均有大幅降低,均<50μg/L,按杂质含量百分比计算不足0.001%,表明精制步骤可有效去除CTAB。3批Hib多糖的粗糖中CTAB残留量为1100~1600μg/L,精糖中CTAB残留量显著降低,精制步骤可有效去除CTAB。虽然精制多糖中残留CTAB占产品质量百分比不到0.004%,但第2批CTAB残留量显著高于1和3批,一定程度上反应了纯化工艺稳定性尚有提升空间。
综上所述,本研究建立的LC-MS/MS法可同时定量CTAB和OBA,上机分析前仅需溶解和稀释样品即可,无需复杂前处理。同时,该方法耗时短,9min内可完成CTAB和OBA的同时测定,并具有良好的精密性及准确度,可用于多种多糖疫苗及多糖结合疫苗的粗糖和精糖中CTAB和OBA残留量的测定。——论文作者:李茂光1,龙珍2,陈琼1,李月琪2,许美凤1,王春娥1,李亚南1,叶强1

 >
>