超高效液相色谱串联质谱法测定中药何首乌中10种真菌毒素的含量
时间:
摘要目的:建立超高效液相色谱串联?质谱同时测定何首乌中10种真菌毒素的方法。方法:样品经70%甲醇提取,再经亲水亲脂平衡(HLB)柱净化处理后进样分析。样品采用WelchUltimateXBC18色谱柱(4?6mm×100mm,2?5μm)进行分离,流动相为甲醇(A)?0?1%甲酸(含5mmol/L乙酸铵)(B),梯度洗脱,流速为0?3mL/min,柱温为40℃;采用电喷雾离子源(ESI)电离样品,多反应监测(MRM)模式下采用基质匹配标准曲线法进行定量分析。结果:10种真菌毒素在各自线性范围内线性关系良好(r>0?9990),检测限(LODs)和定量限(LOQs)分别介于0?50~15μg/kg和1?5~50μg/kg之间。在低、中、高浓度下,10种真菌毒素的平均回收率为62?5%~116?1%;中浓度下,10种真菌毒素的精密度在2?8%~8?7%。结论:该法灵敏度高、结果准确可靠,适用于何首乌中多种真菌毒素的同步测定。
关键词何首乌;真菌毒素;超高效液相色谱串联质谱法
中药材在种植、采收、运输和贮藏过程中易受到多种真菌毒素污染,进而影响中药材质量、药品安全及合格率[1],这一点已经引起了业界和监管部门的高度重视。2010年版《中华人民共和国药典》(以下简称药典)中首次规定陈皮、胖大海、桃仁、酸枣仁和僵蚕5种中药中含有黄曲霉毒素总量不超过10μg/kg,黄曲霉毒素B1(AflatoxinB1,AFB1)不得超过5μg/kg[2],2015年版药典中制定了黄曲霉毒素限量标准的品种增加至19种[3],2020年版药典增加至24种,而且给出了多种真菌毒素的单独测定或者联合测定的分析方法[4]。但是,中药基质复杂,而且不同中药基质不同,因此很难有一种方法适用于所有中药,不同品种样品处理方法和分析方法都有不同[5?7]。因此,药典给出的方法使用到具体品种时也必须经过系统的方法学验证方可确定可行性。
本课题组前期在追踪何首乌肝毒性成因时曾建立了其中12种真菌毒素的LC?MS/MS同步测定方法,并从多批外观完好的何首乌中检测到多种真菌毒素[8],但是所用样品前处理方法和分析方法都与新版药典中规定的10种真菌毒素的同步测定方法有所不同。因此,本文拟采用新版药典四部通则2351项下“六、多种真菌毒素测定法”测定不同批次何首乌中的10种真菌毒素,以考察该方法在何首乌上应用的可行性,并评估当下市场上流通的何首乌样品的质量,为保障何首乌临床使用的安全性和有效性提供检测方法和依据。
1 仪器与试药
1?1 仪器高效液相色谱仪(岛津公司,日本,型号:LC?20ADXR);三重四级杆液质联用仪(岛津公司,日本,型号:LCMS?8050),配有电喷雾离子源(ESI);十万分之一分析天平(梅特勒托利多,瑞士,型号:XS105DU)。数控超声波清洗器(昆山超声仪器有限公司,型号:KQ?500DE),医用离心机(湘仪离心机仪器有限公司,型号:H1850);C18色谱柱(4?6mm×100mm,2?5μm,月旭公司,型号:Ulti?mateXB)。
1?2 试剂甲醇(色谱纯,国药集团化学试剂有限公司,批号:20200217),乙腈(色谱纯,CNW,D6691440),甲醇[质谱纯,霍尼韦尔贸易(上海)有限公司,DW562?CN],甲酸(质谱纯,批号:157296)和乙酸铵(质谱纯,批号:160267A)均购自赛默飞世尔科技有限公司,水为屈臣氏蒸馏水。ShimsenStyra亲水亲脂平衡(HydrophilicLipophilicBalance,HLB)固相萃取柱[60mg/3mL,岛津(上海)实验器材有限公司,批号:48470678S]。AFB1(批号:0841808,浓度2?00μg/mL)、黄曲霉毒素B2(AflatoxinB2,AFB2,批号:0291707,浓度2?50μg/mL)、黄曲霉毒素G1(AflatoxinG1,AFG1,批号:0301707,浓度1?90μg/mL)和黄曲霉毒素G2(AflatoxinG2,AFG2,批号:0311707,浓度2?00μg/mL)均为溶解于甲醇中的溶液,购于北京坛墨质检有限公司。呕吐毒素(Deoxynivalenol,DON,批号:51481?10?8)、赭曲霉毒素A(OchratoxinA,OTA,批号:303?47?9)、玉米赤霉烯酮(Zearalenone,ZEN,批号:17924?92?4)、伏马毒素B1(FumonisinB1,FB1,批号:116355?83?0)、伏马毒素B2(Fumonisin,FB2,批号:116355?84?1)和T?2毒素(T?2toxin,T?2,批号:21259?20?1)均购自Pribo?lab公司,纯度均大于99%。
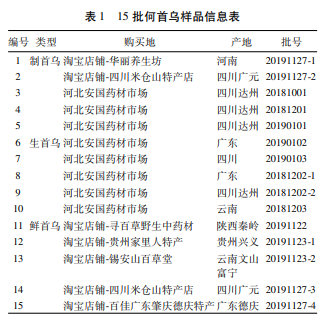
1?3 分析样品从市场购买何首乌样品15批,经中国中医科学院中药研究所生药室李娆娆研究员鉴定为:制首乌5批,生首乌5批,鲜首乌5批(何首乌个子货,也就是何首乌药材),详细信息见表1。鲜首乌的加工方法如下:何首乌个子货,洗去泥沙,趁鲜切成3~5mm厚片,置通风处干燥3~4h后,再放至烘箱中干燥,烘干温度60~70℃,烘3~4h后,再风干、烘干如此交替干燥,持续2~3d,取出冷却至室温后备用。所有样品外观正常,无霉变,无虫蛀。
2 方法与结果
2?1 色谱?质谱条件色谱条件:甲醇(A)?0?1%甲酸(含5mmol/L乙酸铵)(B),梯度洗脱程序为:0~2min,20%~30%A;2~5min,30%~70%A;5~10min,70%~80%A;10~10?5min,80%~95%A;10?5~16min,95%A;16~16?5min,95%~20%A;16?5~20min,20%A;流速:0?3mL/min,柱温:40℃;进样体积:5μL。质谱条件:电喷雾离子源(ElectrosprayIonization,ESI),正负离子电离模式,多重反应监测模式(MultipleReactionMonitoring,MRM);雾化气流速:氮气10?0L/min;碰撞气:氩气;离子源温度:300℃;脱溶剂管温度:250℃;加热模块温度:400℃;相关参数见表2。
2?2 溶液制备
2?2?1 对照品储备液分别准确加入1?00mL甲醇于T?2、FB2、FB1、ZEN、OTA、DON中,混匀,制成浓度均为1mg/mL的上述对照品储备液。
2?2?2 5种真菌毒素混合中间液的制备分别精密吸取“2?2?1”项下T?2、FB2、FB1对照品储备液0?1mL、OTA对照品储备液0?010mL和ZEN对照品储备溶液0?025mL于1mL容量瓶中,用甲醇定容至刻度,制成T?2、FB2、FB1浓度均为100μg/mL、OTA浓度为10μg/mL及ZEN浓度为25μg/mL的5种真菌毒素对照品混合中间液。
2?2?3 10种真菌毒素混合中间液分别精密吸取“2?2?2”项下5种混合真菌毒素中间液0?1mL、甲醇中AFB10?50mL、甲醇中AFB20?20mL、甲醇中AFG10?5mL、甲醇中AFG20?25mL和DON标准储备溶液0?25mL于5mL容量瓶中,用甲醇定容至刻度,混匀,制成DON浓度为50μg/mL,FB2、FB1和T?2浓度均为2μg/mL,OTA浓度为0?2μg/mL,ZEN浓度为0?5μg/mL,AFB1200ng/mL、AFB2100ng/mL、AFG1190ng/mL、AFG2100ng/mL的10种真菌毒素对照品混合中间液。
2?2?4 混合对照品溶液精密量取“2?2?3”项下10种真菌毒素混合中间液50μL于10mL量瓶中,用50%乙腈稀释并定容至刻度,摇匀,制成10种真菌毒素对照品混合溶液。
2?2?5 供试品溶液取本品粉末约5g(过2号筛),精密称定,精密加入70%甲醇溶液50mL,密塞,称定重量,超声(功率500W,频率40KHz)处理30min,取出,放冷,再称定重量,用甲醇补足减失的重量,摇匀,置离心机中,10744×g,离心5min,取出,精密吸取上清液2mL,用水稀释并定容至10mL量瓶中,摇匀。精密吸取5mL,缓慢通过已处理好的HLB柱[规格:3mL(60mg),依次用甲醇和水各3mL洗脱],直至有适量空气通过;随后用5mL甲醇洗脱,收集洗脱液,于40℃氮气缓慢吹干,精密加入50%乙腈溶液1mL混匀,用0?22μm微孔滤膜滤过,取续滤液,即得。
2?3系统适用性试验取空白基质样品(6#样品)5g,按照“2?2?5”项下供试品溶液的制备方法处理至“于40℃氮气缓慢吹干”,然后精密加入“2?2?4”项下的混合对照品溶液1mL,混匀,经0?22μm微孔滤膜过滤,取续滤液,即得系统适应性溶液。取空白基质5g,按照“2?2?5”项下供试品溶液的制备方法制备空白溶液。按“2?1”项下色谱条件将上述2种溶液分别进样5μL,记录色谱图。结果空白溶液中均未检测到10种真菌毒素目标物。取系统适用性溶液连续进样5次,色谱图中10种真菌毒素峰面积相对标准偏差均小于5?0%,系统适用性良好。
2?4专属性试验空白基质溶液、样品溶液、对照品溶液和加标样品溶液在多种真菌毒素出峰位置均没有杂质峰干扰。
2?5标准曲线的制备分别精密吸取“2?2?3”项下10种真菌毒素混合中间液10、20、30、50、100、200μL于10mL量瓶中,用50%乙腈稀释并定容至刻度,摇匀,制成10种真菌毒素的对照品系列溶液。取空白基质样品(6#样品)粉末(过2号筛)约5g,按照“2?2?5”项下供试品溶液的制备方法处理至“于40℃氮气缓慢吹干或至近干”,精密加入1mL上述对照品系列溶液,混匀,用0?22μm微孔滤膜滤过,取续滤液,配制出基质对照品溶液。将基质对照品溶液,按“2?1”项下色谱条件分别进样5μL,记录色谱图。以溶液浓度为横坐标,以目标峰峰面积为纵坐标,绘制标准曲线。见表3。
2?6方法检测限和定量限分别配制DON浓度为1?50ng/mL、AFB1浓度为0?1000ng/mL、AFB2浓度为0?0500ng/mL、AFG1浓度为0?0280ng/mL、AFG2浓度为0?0500ng/mL、FB1浓度为0?0600ng/mL、FB2浓度为0?0600ng/mL、T?2浓度为0?1000ng/mL、OTA浓度为0?1000ng/mL、ZEN浓度为0?0500ng/mL的基质对照品溶液,按“2?1”项下色谱条件进样5μL,按照S/N=3计算检测限。当何首乌基质样品称样量为5g,定容体积为50mL时,10种真菌毒素检测限见表3。配制DON浓度为5?0ng/mL、AFB1浓度为0?200ng/mL、AFB2浓度为0?160ng/mL、AFG1浓度为0?0800ng/mL、AFG2浓度为0?160ng/mL、FB1浓度为0?200ng/mL、FB2浓度为0?200ng/mL、T?2浓度为0?400ng/mL、OTA浓度为0?320ng/mL、ZEN浓度为0?150ng/mL的基质对照品溶液,按“2?1”项下色谱条件进样5μL,按照S/N=10计算定量限。当基质称样量为5g,定容体积为50mL时,10种真菌毒素定量限见表3。
2?7准确度试验取本品粉末(6#样品)约5g(过2号筛),精密称定,分别精密加入“2?2?3”项下0?065、0?125、0?18mL10种真菌毒素混合中间液,按“2?2?5”项下的“供试品溶液制备方法”制备成低、中、高3个浓度的加标供试品溶液,每个浓度平行3份,按“2?1”项下色谱质谱条件进样5μL,结果显示,10种真菌毒素的平均加样回收率62?5%~116?1%,相对标准偏差(RelativeStandardDeviation,RSD)为1?0%~9?0%,表明该方法的准确度良好。见表4。
2?8精密度试验取“2?8”项下的中浓度加标供试品考察方法的精密度。平行制备6份,按“2?1”项下色谱条件进样5μL,考察方法的精密度。结果显示,10种真菌毒素的RSD均小于10%,表明方法的重复性良好。10种真菌毒素的平均含量及RSD分别为:DON(1139?4μg/kg,3?9%)、AFB1(3?1μg/kg,3?0%)、AFB2(2?2μg/kg,6?0%)、AFG1(3?1μg/kg,4?9%)、AFG2(1?9μg/kg,8?7%)、FB1(35?9μg/kg,8?2%)、FB2(54?3μg/kg,7?3%)、T?2(56?5μg/kg,2?8%)、OTA(5?0μg/kg,5?2%)、ZEN(8?9μg/kg,6?1%)。
2?9稳定性试验取“2?8”项下的中浓度加标供试品溶液,在室温放置0、1、6、13h后依“2?1”项下色谱条件分别进样5μL,测定10种真菌毒素的峰面积。结果显示,10种真菌毒素峰面积的RSD均小于5?0%,分别为:DON(3?0%)、AFB1(1?7%)、AFB2(1?6%)、AFG1(4?2%)、AFG2(1?4%)、FB1(3?3%)、FB2(3?8%)、T?2(2?1%)、OTA(1?6%)、ZEN(3?3%),结果表明上述溶液在室温放置13h内稳定性良好。
2?10样品测定取15批何首乌样品,按照“2?2?5”项下方法制备供试品溶液,平行2份,按“2?1”项下色谱条件下进样5μL,记录色谱图。采用基质匹配标准曲线法计算含量。结果显示,有3批样品中检出了真菌毒素,其中1#制首乌中检出FB2(3?4μg/kg),10#生首乌中检出AFB2(53?5μg/kg),11#鲜首乌中检出FB1(1?9μg/kg),其他批次样品无真菌毒素检出。
3 结论与讨论
本文参照2020年版药典四部通则2351“真菌毒素测定法”中发布的LC?MS/MS方法建立了何首乌中10种真菌毒素的LC?MS/MS测定方法,试验中优选了供试品溶液制备方法,优化了色谱?质谱条件,并对新建方法进行了全面的方法学考察,结果均符合含量测定要求,证明所建方法可用于何首乌中10种真菌毒素的同步测定。
2020年版药典四部通则2351项下“六、多种真菌毒素测定法”的色谱条件为采用0?01%甲酸?甲醇?乙腈系统,梯度洗脱。研究中发现,该条件下黄曲霉毒素的响应值过低且分离度不好,因此我们又参照该通则中黄曲霉毒素测定法中第二法的色谱条件进行试验,结果黄曲霉毒素的响应值大大提高,而且DON的噪声也有减少。经过反复优化,最终确定以甲醇为流动相A,0?1%甲酸(含5mmol/L的乙酸铵)为流动相B,梯度洗脱,获得满意结果。
相关知识推荐:中药类论文发表的核心期刊
课题组前期曾采用LC?MS/MS方法检测了41批何首乌中12种真菌毒素的含量,结果显示:表面完好的34批何首乌中的8批都检出数量不等的多种真菌毒素,其中1批制首乌中的AFB1超标达到了6?8μg/kg[8]。郭丽敏等[9]采用70%甲醇超声提取药材免疫亲和柱净化处理样品,高效液相色谱?柱后衍生?荧光检测器检测的方法测定了15批何首乌样品中4种黄曲霉毒素的总量,结果有1批样品含量达到10μg/kg,1个自制阳性样品[制首乌饮片100g,用冷水泡5h后,装塑料袋内,置潮湿阴暗处(温度30℃),待表面布满霉菌丝后,在阳光下干燥,1周后洗去表面霉菌蒸30min后干燥即可]中4种黄曲霉毒素总量达到25μg/kg,其他13批均低于2μg/kg。结合本次试验结果,1批生首乌中检出AFB2(53?5μg/kg)且含量较高,估计与鲜何首乌在加工前晾晒不充分,在保存中因含水量过大导致霉菌增生有关。因此,实行何首乌产地加工一体化,鲜品何首乌在产地采收后尽快切片干燥是非常必要的,同时我们建议在药典标准中增加何首乌中黄曲霉毒素的限量检查,标准同2020年版药典中有黄曲霉毒素的各品种项下的要求,即黄曲霉毒素B1的含量不得超过5μg/kg,黄曲霉毒素B1、B2、G1、G2的总量不得过10μg/kg。本次测定中虽然有1批何首乌中检出了FB1(1?9μg/kg),1批检出FB2(3?4μg/kg),但因其含量均远远低于欧盟规定的玉米淀粉中FB1的限量标准(1000μg/kg),其余7种真菌毒素在所有批次何首乌样本中均未检出,因此暂不制定何首乌中这些真菌毒素的限量标准。
何首乌的肝毒性问题引起国内外的广泛关注,学界也就其肝毒性成因掀起了研究热潮,但是导致其肝毒性的主要物质基础至今没有定论[10]。目前认为的毒性成分有3类,蒽醌类(大黄素,大黄素甲醚,大黄酸等)、二苯乙烯苷类(主要是生首乌含有的顺式二苯乙烯苷类)以及鞣质类[11?16],但是这些成分都需要大量给药条件下才能产生毒性,而且成分之间相互作用后结果也不清楚,所以至今没有定论。黄曲霉毒素等真菌毒素的肝毒性明确且肯定,因此对于何首乌的外源性污染问题不容忽视,有可能是其导致肝毒性的重要原因。在建立可靠的测定方法的基础上,应加强市场上何首乌样品的大量检测以观察其平均污染水平,进而保证其临床使用的安全性和有效性,也为其肝毒性成因探索提供新的方向。——论文作者:白思宇1,2陈倩雯1冯伟红1荣立新2李春1王智民1

 >
>