由糖基供体和糖基配体直接合成芳基或杂芳基C-核苷的研究进展
时间:
摘要C-核苷与自然界广泛存在的N-核苷的结构高度类似,不同之处是C-核苷中核糖与碱基是通过碳-碳键相连接的.C-核苷也可以被细胞内与N-核苷相关的酶所识别和利用,从而抑制酶促的核酸的合成或降解,进而抑制病毒或者癌细胞的增殖,用于治疗2019新型冠状肺炎的C-核苷药物remdesivir的临床应用引起人们对C-核苷合成的关注.由糖基供体和糖基配体直接偶联能高效合成芳基或杂芳基C-核苷,我们从核糖衍生物与有机金属试剂的反应、过渡金属催化的核糖衍生物与有机金属试剂的反应、酸催化的核糖衍生物的傅克反应三种主要合成策略总结近年来合成芳基或杂芳基C-核苷的文献方法,每个反应类型中又分别从半缩醛核糖、核糖内酯、卤代核糖和核糖烯等不同糖供体角度展开讨论,并对反应中α或β构型产物的生成机理进行了详细说明.
关键词C-核苷;抗病毒药物;Heck反应;傅克反应
构成核酸的单体核苷酸是由核糖或脱氧核糖、碱基(A、T、C、G、U)和磷酸三部分组成,其中核糖和碱基通过C—N键相连构成核苷,核苷再与磷酸结合构成核苷酸.自然界中也存在极少量的C-核苷.C-核苷同样由核糖或脱氧核糖与碱基两部分组成,但两部分是通过C—C键相连接.与自然界大量存在的N-核苷相比,C核苷中的C—C键在酸性条件下更稳定,同时C-核苷对能够断裂N-核苷中的碳氮键的核苷水解酶、磷酸化酶较为惰性.此外仅将N-核苷的C—N核苷键变为C—C核苷键,核苷的碱性和极性一般会减弱,同时碱基形成氢键的能力也会有所改变[1].由于其与N-核苷结构相似,C-核苷可以被生命体中与核苷相关的酶所识别和利用,从而抑制相关酶的活性或影响酶所催化的核酸的合成或降解,进而抑制病毒或者癌细胞的增殖,所以C-核苷原则上可以作为靶向任何与核苷相关酶的潜在药物[2].
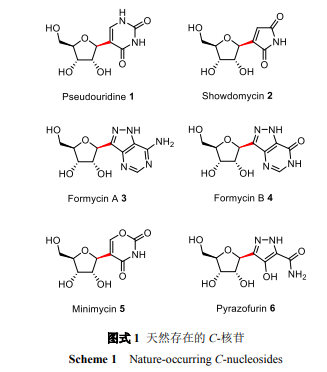
1957年人们从转运RNA中分离得到第一个天然的C-核苷pseudouridine[3],研究表明位于非反密码子区域的结构类似尿苷的pseudouridine能够稳定转运RNA的结构,而位于反密码子区域的pseudouridine能够增强密码子与反密码子之间的碱基配对,从而增加翻译的速率和准确度[4].随后其它天然的C-核苷showdomycin[5]、formycinA、formycinB[6]、minimycin[7]、pyrazofurin[8]等也被分离和鉴定(Scheme1).Pyrazofurin具有抗肿瘤、抗水疱性口炎病毒以及抗恶性疟原虫的活性.Pyrazofurin在体内被磷酸化后能够抑制乳清酸核苷酸脱羧酶的活性,而该酶能催化乳清酸核苷酸转化为尿嘧啶核苷酸的过程,单磷酸pyrazofurin对乳清酸核苷酸脱羧酶的抑制导致体内尿嘧啶核苷酸浓度不足,从而抑制了细胞或病毒RNA的合成[2].
人工合成的C-核苷tiazofurin(Scheme2)能够抑制包括Lewis肺癌细胞在内的多种癌细胞的增殖,tiazofurin首先转化为噻唑-4-羧酰胺腺嘌呤二核苷酸(TAD),结构类似烟酰胺腺嘌呤二核苷酸(NAD)的TAD与次黄嘌呤单磷酸脱氢酶(IMPDH)结合后能够抑制其所催化的肌苷-5'-单磷酸氧化为黄嘌呤-5'-单磷酸的过程,而该步反应是体内合成鸟嘌呤核苷酸的决速步,所以TAD对IMPDH的抑制使体内鸟嘌呤核苷酸的浓度降低,从而抑制了肿瘤细胞DNA和RNA的合成[9].
C-核苷更为重要的用途是作为抗病毒药物,C-核苷药物GS-5734(remdesivir)和BCX4430(galidesivir)都具有治疗2019新型冠状肺炎的作用,已经获批使用的remdesivir作为最有希望的抗病毒药物曾受到人们的广泛关注(Scheme3)[10].GS-5734在动物模型中对埃博拉病毒、MERS病毒有很好的抗病毒活性[11].BCX4430(galidesivir)在体外对埃博拉病毒、马尔堡病毒等丝状病毒有抗病毒活性[12],在黄热病小鼠模型中也表现出很高的抗病毒活性[13].这两种C-核苷药物抗RNA病毒的作用机理相似,它们均靶向病毒复制所必须的依赖RNA的RNA聚合酶(RdRp),它们在细胞内被磷酸化为相应的三磷酸核苷后被病毒的RdRp识别脱去焦磷酸形成单磷酸核苷,随后被嵌入到正在合成的病毒RNA链中,导致生成的病毒RNA链结构扭曲,因RdRp无法识别扭曲的RNA链,使病毒RNA链的合成过早终止[12,13].另一个C-核苷抗病毒药物8在细胞实验中具有抗流感病毒的活性(Scheme3).作为嘌呤核苷酸的类似物,三磷酸化的C-核苷8可以被甲型流感病毒的RNA聚合酶引入到正在合成的RNA链中,导致病毒RNA链的合成过早终止.而且由于C-核苷8与两种嘧啶碱基都能配对,嵌入8的RNA在转录或复制时会发生尿嘧啶与胞嘧啶互变的突变,从而导致病毒失去感染能力[14]
前述的这些具有抗肿瘤或抗病毒活性的核苷在结构上都是具有β构型,同时糖配基是芳香杂环的C-核苷.虽然后来发现remdesivir不是2019新型冠状肺炎的特效治疗药物,但是具有确切的治疗效果,美国一半以上的COVID-19住院患者接受了remdesivir的治疗.其它一些C-核苷类药物也是治疗2019新型冠状肺炎的备选药物.鉴于开发特效的抗2019新型冠状病毒的药物迫在眉睫,同时人们对抗其它致病病毒的药物和抗肿瘤药物也有迫切需求,发展高效合成β-C-芳基核苷的方法具有重要意义.
相关知识推荐:发表有机化学领域论文水平高的期刊
目前已有一些合成C-芳基核苷的方法被报道,主要分为以非糖底物起始和以糖为底物起始合成C-芳基核苷[15,16].其中以糖为底物合成C-核苷也可分为两种主要策略,一种策略是在糖基供体上先引入可在后期进行进一步转化的官能团,例如氰基、炔基、烯基等,再由这些基团的后续转化合成所需的C-核苷;另一种策略是由糖基供体和糖基配体直接偶联合成C-核苷,由于第二种策略更为简洁,本文仅对通过这种策略合成C核苷的合成方法进行综述.用该策略合成C-芳基核苷要求以简单易得的糖供体为底物,在温和条件下高效和高β选择性地引入糖基配体(通常是芳香环或杂环).本文先以反应类型分类,再对每个反应类型中不同的糖基供体,例如半缩醛核糖、核糖内酯、卤代核糖和核糖烯等分别进行讨论.
1核糖衍生物与有机金属试剂的反应
保护的半缩醛核糖很容易通过核糖的环化、上保护制备,它们具有醛的反应性,能与有机金属试剂在低温下发生加成反应生成二醇,该二醇再经酸催化或者在Mitsunobu反应条件下环化生成C-核苷(Scheme4).
Brown等以2,3,5-三-O-苄基核糖9为原料通过该策略合成了pseudouridine(1)[17].首先保护的核糖9与芳基锂试剂反应以64%的产率得到一对非对映异构体10,随后在盐酸/甲醇条件下环化并脱除叔丁基保护,以90%的收率得到化合物11,最后在三氯化硼条件下脱苄基保护得到α∶β比为2∶5的产物,经离子交换色谱分离以42%的收率得到pseudouridine(1).如果二醇10在三氯化硼作用下一步环化并脱苄基保护,仅能得到α∶β比为1∶1的产物(Scheme5).
同样的,2,3,5-三-O-苄基核糖9与苯基溴化镁反应生成二醇12,随后在对甲苯磺酸/苯回流条件下环化得到β构型为主的化合物13,最后三溴化硼脱苄基保护,重结晶纯化后得到β-苯基-C-核苷14(Scheme6)[18].
用类似方法还可以合成吡唑C-核苷[19],首先2,3,5-三-O-苄基核糖9与N-砜基保护的吡唑锂试剂在甲苯中反应以3∶1的非对映选择性得到二醇15,这步反应中溶剂的选择对二醇15的产率影响很大,如果选用四氢呋喃或乙醚为溶剂则产率仅为18%.随后二醇15在盐酸回流条件下脱去砜基保护生成二醇16,再在Mitsunobu反应条件下环化为α∶β比为1∶27的C-核苷17.在该环化过程中二醇16首先进攻膦正中间体形成环化中间体A,吡唑取代基协助中间体A中三丁基氧膦的脱除,环化时构象C中C2'的苄氧基与C1'取代基的位阻作用导致构象C的能量更高,因此中间体更倾向于以B构象进行环化生成β构型的C-核苷17,随后在Pd(OH)2/C条件下经氢化脱去苄基保护,以四步62%的总收率得到C-吡唑核苷18(Scheme7).然而该方法当使用脱氧核糖19为底物时环化的立体选择性会降低,只能以四步31%的总收率和α∶β比为1∶4得到产物23(Scheme8),这是因为环化中间体的C构象中的糖基为脱氧核糖时,2位位阻的减小导致构象C和构象B的能量差缩小,从而导致β选择性降低.
4位羟基被保护的开环核糖同样存在醛基,能与有机金属试剂加成生成醇,随后在酸催化下4位羟基的保护基脱除并发生环化得到目标C-核苷(Scheme9).
Solomon等[20]通过该策略在脱氧核糖的1位引入吡啶,首先醛24与吡啶锂试剂反应生成醇25(无立体选择性),醇25上的羟基与甲磺酰氯反应得到离去性好的甲磺酸酯26,最后在三氟乙酸/氯仿条件下脱除缩酮保护基并发生环化,环化的同时3位羟基上的硅基保护也被脱除,最后以三步31%的总收率得到β-C-核苷27(Scheme10).
Benhida[21]利用相似的策略合成了C-核苷31(Scheme11),4位羟基被保护的脱氧核糖28与2-溴噻吩锂反应生成醇29(R∶S=2∶3),随后在对甲苯磺酸/甲苯回流条件下脱去4位羟基的缩酮保护并环化,以86%的收率得到化合物30,最后TBAF脱去其硅基保护,以三步66%的总收率得到α∶β比为2∶3的C-脱氧核苷31.——论文作者:李非凡渠瑾*

 >
>