ANLN缺失后Hela细胞的力学特性与骨架蛋白变化分析
时间:
摘要背景:目前关于ANLN蛋白在细胞分裂间期调节细胞形态、细胞-细胞间接完整性以及胞质分裂中稳定收缩环的作用已经明确,但其对细胞力学性能和骨架蛋白的影响还鲜有报道。目的:探讨ANLN缺失对分裂间期细胞力学特性与骨架蛋白的影响。方法:通过原子力显微镜分别测量正常Hela细胞与siRNA敲降ANLN的Hela细胞的表面弹性模量和破膜力;采用激光共聚焦显微镜观察正常Hela细胞与siRNA敲降ANLN的Hela细胞的肌球蛋白ⅡA以及肌动蛋白纤维分布特征。结果与结论:①敲降ANLN的Hela细胞的表面弹性模量明显高于未经处理的正常Hela细胞,与敲降ANLN的细胞相比,正常细胞的表面弹性模量更倾向于极性分布(两极间逐步降低),但两组细胞长轴边缘区域的破膜力并没有明显差别;②ANLN敲降组细胞在边缘位置有较低的肌球蛋白ⅡA分布;③ANLN敲降组近底层细胞-细胞连接区域的肌动蛋白纤维趋向更散乱,并且细胞内纤维束沿长轴排列不明显,中层有细胞间隙变大的倾向;④结果说明,敲降ANLN对细胞的边缘区域影响最大,ANLN的缺失会导致细胞边缘区域更频繁的重构,细胞需要聚集更多的骨架蛋白及其结合蛋白来稳定细胞状态,导致了更高的表面弹性模量。
关键词:ANLN蛋白;细胞铺展;原子力显微镜;力曲线;表面弹性模量;破膜力;细胞骨架;肌动蛋白纤维;国家自然科学基金
0引言Introduction
Anillin(ANLN)是一种高度保守的多结构域蛋白,ANLN与Rho激酶、肌动蛋白纤维和肌球蛋白细胞骨架主要组分相互作用,在胞质分裂时负责稳定收缩环[1-8]。ANLN在细胞-细胞连接中同样发挥关键作用,敲降ANLN会破坏紧密的胞间连接,导致细胞形态变化并增大细胞间的间隙[9-10];同时会引起细胞间连接处的Rho激酶、肌动蛋白纤维和肌球蛋白异常,胞质分裂期甚至会导致分裂失败[4-7,11]。ANLN作为胞内重要的脚手架蛋白,其作用机制和形式目前已较为明确,但其所能引起的细胞力学特性改变却鲜有报道。细胞的力学特性在细胞的形态维持、运动和迁移、细胞间连接的形成以及细胞与细胞外基质的作用中均发挥重要作用[12-13]。细胞的表面弹性模量是细胞力学的重要参数,与细胞结构和功能密切相关,一般认为由细胞骨架来决定细胞表面弹性模量,其中肌动蛋白纤维起主要作用,肌球蛋白和中间纤维等也较为重要[14-17],而ANLN作为细胞骨架中重要的脚手架蛋白,其缺失可能对细胞的力学性能有很大影响,因此实验探讨ANLN缺失对细胞力学特性和骨架蛋白的影响。
原子力显微镜以其高精度、可进行活细胞操作被视为测量细胞的主要手段[18-20],可测量形貌和表面弹性模量等特征[15-16,21]。实验采用原子力显微镜技术分析ANLN敲降细胞与正常细胞表面弹性模量分布以及细胞膜破坏力的差异,并比较肌动蛋白纤维的分布特征,为细胞铺展、细胞间相互作用的认识和调控,以及癌变组织微环境的研究提供支持。
1材料和方法Materialsandmethods
1.1设计细胞学实验。
1.2时间及地点于2017年4月至2018年12月在太原理工大学生物医学工程学院完成。
1.3材料
1.3.1细胞株Hela细胞(人宫颈癌细胞株)购于美国菌种保藏中心。
1.3.2实验试剂与仪器HEK293V细胞(人胚肾细胞)(美国菌种保藏中心,美国);PEG慢病毒纯化试剂盒(英茂盛业公司,中国);BamHⅠ、EcoRⅠ内切酶、FermentasT4DNA连接酶、大肠杆菌感受态细胞(DH5α)(大连宝生物Takara,中国);pCMV-mCherry-MHC-IIA质粒(35687,Addgene,美国);TrizolRNA提取试剂(Omega公司,日本);PlasmidPlusMiniKit质粒提取试剂盒(Qiagen公司,德国);低糖DMEM培养液(Hyclone公司,美国);胎牛血清(Gibco公司,美国);Phalloidin-TetramethylrhodamineBisothiocyanate(p1951,Sigma公司,美国);35mm培养皿(NEST公司,中国);CO2细胞培养箱(ThermoFisher公司,美国);实时荧光定量PCR仪(ABI公司,德国);CCD图像采集系统(DP73,奥林巴斯公司,日本);加热环(自制);激光共聚焦显微镜(FV1000,奥林巴斯公司,日本);原子力显微镜(BioScopeCatalyst,布鲁克公司,美国)。
1.4实验方法
1.4.1ANLN敲降细胞株的获取人工设计的寡核苷酸片段要插入载体中特定的酶切位点中[17,22]。导向目标基因ANLNmRNA而设计的19nt的干扰片段,包含于寡核苷酸。化学合成正向和反向两条寡核苷酸,正、反向寡核苷酸退火后与载体连接,插入BamHⅠ、EcoRⅠ位点之间,见表1。
连接线性化pLVshRNA-EGFP(2A)Puro载体并用连接后产物转化大肠杆菌感受态细胞(DH5α),采用QiagenPlasmidPlusMidiKit质粒提取试剂盒提取;将ANLNRNA干扰慢病毒载体及空白慢病毒载体与pH1、pH2共转染293V细胞,包装ANLNRNA干扰慢病毒及对照慢病毒,用PEG慢病毒纯化试剂盒纯化病毒。利用得到的慢病毒载体感染Hela细胞,并挑选具有抗性的单克隆细胞株进行鉴定。目的基因引物:ANLN-F:GCTGATGATGCGTCTTTGGT;ANLN-R:CTCCCTTGGATGGAACTGTCT;内参引物:GAPDH(H)-F:CAAGGGCATCCTGGGCTACACT;GAPDH(H)-R:CTCTCTCTTCCTCTTGTGCTCTTGC。得到ANLN敲降率约90%的单克隆Hela细胞株。
1.4.2细胞实验准备细胞培养于37℃,体积分数5%的CO2细胞培养箱中。待测细胞经胰酶消化重新接种于35mm培养皿,生长48h后进行原子力显微镜测量、肌动蛋白纤维荧光染色、激光共聚焦显微镜分析等。
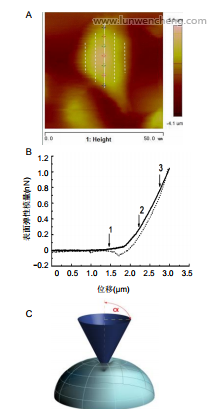
1.4.3原子力显微镜测定细胞的表面弹性模量通过原子力显微镜对正常Hela细胞以及敲降ANLN的Hela细胞进行形貌扫描后,将细胞长轴均匀划分为8份,对称选取7个点,在长轴两侧各取两条平行长轴的线,分别对称且均匀的取5个和3个点,见图1A。将作用力控制为1nN,每个测量点获取3条力曲线,可获得力-距离曲线,见图1B,通过拟合力曲线得到表面弹性模量,可分析得出细胞表面力学特性分布。
图1B为典型的贴壁细胞力曲线,曲线从左至第1个箭头处呈水平直线,力基本不变,表示微悬臂还未发生偏转,说明针尖还未与细胞接触;当针尖下压至第1个箭头处时,力曲线呈非线性,表明针尖开始接触细胞表面并逐渐下压细胞,悬臂发生偏转,细胞呈非均质弹性体;针尖继续下压到第2个箭头处,力曲线开始表现为拟线性状态,可近似将细胞看为一种均质弹性体[8,23]。通过拟合第2个箭头至第3个箭头间曲线的斜率可大致推断近似弹性体状态下的细胞表面弹性模量。
1.4.4原子力显微镜测定细胞破膜力[24]使用原子力显微镜对正常以及敲降ANLN的Hela细胞进行形貌扫描后选取细胞长轴边缘区域(1.5-2.5μm)进行破膜实验,即逐渐增大施加于细胞表面的力,直到细胞膜破裂为止,根据产生的力-距离曲线读取并记录破膜力,见图2。
1.4.5肌动蛋白纤维与肌球蛋白ⅡA的分布实验分别测定正常和敲降ANLN的Hela细胞株的肌动蛋白纤维与肌球蛋白ⅡA的分布,其中肌动蛋白纤维分布采用罗丹明鬼笔环肽对肌动蛋白染色,肌球蛋白ⅡA分布采用pCMV-mCherry-MHC-IIA转染后筛选得到的能稳定表达荧光肌球蛋白ⅡA的细胞株。
1.5主要观察指标①原子力显微镜得到的力曲线及其表面弹性模量、破膜力;②肌球蛋白ⅡA在活细胞内沿长轴的荧光强度分布;③肌动蛋白纤维的固定荧光染色结果。
1.6统计学分析使用SPSS13.0统计软件,采用单因素方差分析,P<0.05为差异有显著性意义。
推荐阅读:骨伤护理方面的论文文献
2结果Results
2.1ANLN敲降细胞的表面弹性模量分布实验数据预处理方法为各点数据除去一个最大值和一个最小值,近中心短轴(Up-mid或Down-mid位置)扩大50%(或者缩小25%);短轴末端(Top或Bottom位置)扩大100%(或缩小50%),通过Origin8.1软件绘制ANLN敲降组的方差分布图,正常组、敲降组的均值对比图,见图3。从图3中可见,正常组与ANLN敲降组细胞长轴、短轴的表面弹性模量分布都不对称;敲降组的表面模量明显高于正常组,在平行长轴的各组相应数据中,1-1',2-2',3-3',4-4',5-5'组间差异均有显著性意义(P<0.05);正常组细胞的模量更倾向于两极间逐步降低,ANLN敲降组的两极表面弹性模量高于中心区域。
2.2长轴末端的ANLN敲降细胞的破膜力分布图4为ANLN敲降组和正常细胞长轴边缘区域(1.5-2.5μm)内的破膜力对比图,其中星点代表正常细胞组,方块代表ANLN敲降组,在长轴边缘区域,两组细胞的破膜力并没有明显差别,且破膜力均表现出随细胞高度增加而增加的趋势。
2.3肌球蛋白ⅡA在细胞内的分布特征以核区最小值为基准值进行荧光强度归一化,以总轴长为基准值进行轴长归一化,取得方差曲线后进行平滑处理,见图5A,并对末端区域的荧光强度做了对比,见图5B,可见ANLN敲降组细胞在边缘位置有较低的肌球蛋白ⅡA分布,差异有显著性意义(P<0.05)。
2.4肌动蛋白纤维在细胞内的分布特征图6为ANLN敲降Hela细胞与正常Hela细胞的肌动蛋白纤维分布差异对比图,从图6中可以看出,ANLN敲降组与正常组细胞的肌动蛋白纤维分布主要差异在于:ANLN敲降组近底层细胞-细胞连接区域的肌动蛋白纤维趋向更散乱,并且细胞内纤维束沿长轴排列不明显。在中层确实有细胞间隙变大的倾向,但是中层的肌动蛋白纤维在两组间并未出现显著不同。
3讨论Discussion
一直以来,细胞的表面弹性模量被认为区别正常细胞和癌细胞的重要指标之一[14,16],表面弹性模量也是细胞力学性能的重要指标。鉴于ANLN是细胞骨架的重要调控和组成成分,作者针对细胞的表面弹性模量进行了测量,判断ANLN蛋白对细胞表面弹性模量的影响。ANLNRNA稳定敲降的Hela细胞表面弹性模量明显高于未经处理的正常Hela细胞,以往研究表明癌细胞表面弹性模量要比正常细胞低的多[25-26],而癌变细胞中ANLN的含量高于正常细胞[27],因此可以认为敲降ANLN后Hela细胞的表面弹性模量增大是合理的,并且发现在细胞内肌动蛋白纤维和肌球蛋白ⅡA分布减少,这是ANLN不足导致的[9],作者推测ANLN的不足促进了细胞骨架的重组,敲降细胞需要聚集更多贡献表面弹性模量的其他骨架蛋白及其结合蛋白来稳定细胞状态,导致了更高的表面弹性模量。敲降细胞骨架的重构尤其是细胞边缘区域的重构更为明显,具体表现为敲降细胞边缘区域表面弹性模量差异和方差更大,细胞边缘聚集的肌动蛋白纤维更多,虽然肌球蛋白ⅡA聚集少于正常细胞,更加说明在细胞表面弹性模量的众多影响因素中,肌动蛋白纤维占首要位置[14-17]。
ANLN蛋白的影响甚广,不仅严重影响着细胞的表面弹性模量,更是通过Rho激酶、肌动蛋白纤维等相互作用,影响细胞间连接的完整性[9-10],敲降ANLN的细胞边缘区域的肌动蛋白纤维排布散乱,导致细胞间连接不再完整,直接体现在细胞间隙变大。有研究表明ANLN在胞质分裂期还可通过纺锤体微管连接收缩环从而促进细胞极性的确立和正常分裂[11],从荧光染色结果可看出细胞内纤维束沿长轴排列不明显,这表明严重缺乏ANLN的细胞在极性建立上较差,而正常细胞的表面弹性模量更趋于极性化(两极间逐步降低)也再次支持了这个结果。此外,ANLN还可通过影响隔膜蛋白的定位来控制细胞膜的完整性[2,28],因此实验对比了两组细胞长轴边缘区域的破膜力,但并未有明显差异,破膜力与以往研究中的增长趋势相同[29-30],推测原因可能是ANLN虽然对细胞膜的完整性有影响,但影响较小或可忽略不计,也可能是因为边缘区域更为明显的重构聚集了大量隔膜从而保证了细胞膜的完整性,具体的原因和机制还有待更深入研究。
综上可知,ANLN对Hela细胞的力学特性有显著性影响,尤其是对细胞表面刚度的影响,ANLN的匮乏使得细胞表面弹性模量增大,同时也导致细胞间连接变弱,有可能影响着癌变组织的聚集和转移能力,目前存在很多针对力学特性对肿瘤微环境、生物组织影响的研究[12,31-32],因此ANLN的缺失对细胞层面的基础研究是必要且有意义的,可为癌变组织的检测以及治疗提供有力参考依据。

 >
>