单域抗体的研究和应用进展
时间:
摘要:传统IgG抗体分子一般由轻链和重链组成,轻链包含1个可变区(VL)和1个恒定区(CL),重链包含1个可变区(VH)和3个恒定区(CH1,CH2,CH3)。单域抗体(Singledomainantibody,sdAb),是指缺失抗体轻链而只有重链可变区的一类抗体,因其分子量小,也被称为纳米抗体(Nanobody)。20世纪90年代,单域抗体最早在骆驼科动物中被发现,之后在护士鲨、大星鲨和鳐鱼等软骨鱼纲动物中也发现了类似的抗体。单域抗体虽然结构简单,但仍然可以达到与传统抗体相当甚至更高的与特异抗原结合的亲和力。相比于传统抗体,单域抗体具有分子量小、稳定性强、易于重组表达等优点。近年来在生物学基础研究和医学临床应用方面均备受关注并被广泛应用。文中将从单域抗体的结构特征、理化性质、筛选方法及其在生物医学领域的重要应用进展进行综述。
关键词:重链抗体,单域抗体,骆驼,纳米抗体
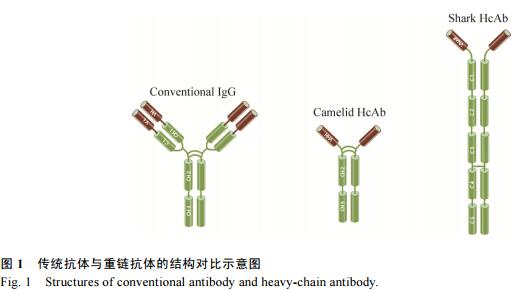
传统抗体分子(IgG)在结构上是由两条相同的重链和两条相同的轻链组成,此种结构在哺乳动物中均是非常保守的。抗体分子的轻链包含了1个VL区和1个CL区(图1),而重链则拥有1个VH区和3个CH区(CH1、CH2和CH3)。VH区和VL区之间通过二硫键相互连接形成抗体的可变区(Fv),是抗体识别抗原的最小单位,抗体可变区的序列差异决定了抗体能够特异地识别不同的抗原。而CL区和CH区则是相对保守的,被称为抗体的恒定区,其中CH区的CH2和CH3两个区域对于抗体招募免疫细胞发挥ADCC(抗体依赖的细胞介导的细胞毒性作用)和CDC(补体依赖的细胞毒性作用)功能有着重要的作用[1-2]。
1993年布鲁塞尔自由大学的Hamers-Casterman等首先报道了骆驼血液中除了传统的IgG抗体外还存在另一种类型的抗体,与传统的哺乳动物抗体IgG分子结构不同,这种抗体既缺失传统抗体的轻链,也缺少重链恒定区的CH1区域,被称为重链抗体(Heavychainantibody,HcAb)。重链抗体的可变区仅由抗体重链的可变区组成(图1),与传统抗体的Fab类似,该可变区可以与抗原特异性结合,因此重链抗体可以发挥和传统抗体一样的功能。在哺乳类动物中,目前只有在胼足亚目的骆驼科动物血液中发现含有功能性的重链抗体,同属于偶蹄目的反刍亚目和猪形亚目动物体内未发现这类抗体[3]。HcAb普遍存在于各种骆驼科动物中,包括单峰驼Camelusdromedarius、亚州双峰驼Camelusbactrianus、南美洲的大羊驼Lamaglama、原驼Lamaguanicoe、羊驼Vicugnapacos等,尽管其所占比例略有不同,如在南美洲羊驼的血液中重链抗体比例为10%–25%,而在普通的双峰骆驼中则高达50%–80%[4-5]。除了骆驼科动物外,在护士鲨(又称为铰口鲨,Nurseshark,Ginglymostomacirratum)、大星鲨(Smoothdogfish,Musteluscanis)、白斑角鲨(Spinydogfish,Squalusacanthias)、鳐鱼(Skate)和鱼(Ray)等软骨鱼纲动物血液也存在类似结构的抗体。在这些远古的物种血液中除了有异源四聚体的IgM和IgW抗体外,还有一种被称为新抗原受体(Ignewantigenreceptor)的重链抗体,简称为IgNAR[6],这类抗体由两个相同的重链组成,重链包含5个恒定区和1个可变区(图1)。
无论是骆驼科动物来源的HcAb还是软骨鱼来源的IgNAR,其特异性结合抗原的均为单一重链的可变区,分别被称为VHH(Variabledomainofheavychainofheavy-chainantibody,VHH)和VNAR(Variabledomainofnewantigenreceptor,VNAR)。采用分子生物学技术直接克隆并重组表达VHH或VNAR,可获得只含有单个结构域的最小单元抗原结合片段,被称为单域抗体(Single-domainantibodies,sdAbs),亦被称为纳米抗体(Nanobody)。单域抗体通常只由110–130个氨基酸组成,分子量仅有12–15kDa,远远小于传统完整抗体(150–160kDa)及其Fab片段(约50kDa),但却能具备与传统抗体相似或更高的特异性抗原亲和力。单域抗体固有的分子量小、理化特征稳定、亲和力高和易于重组表达制备的特点使得其在被发现后备受关注,经过20多年的研究,在免疫研究、诊断检测、医学和生物学成像、治疗性抗体发展等领域的应用均取得了积极进展。文中主要从sdAbs的结构和理化特征、筛选和制备方法、在生物学和医学研究中的应用等方面总结分析了单域抗体的新近研究进展,并展望了其进一步发展和应用的前景以及面临的问题。
1单域抗体的理化性质
相比于传统抗体而言,单域抗体有着独特的理化性质。主要包括以下几点:1)单域抗体的分子量小,因为没有轻链的存在,单域抗体VHH的大小只有15kDa左右,鲨鱼来源的单域抗体VNAR因为缺少CDR2区(Complementaritydeterminingregion2,互补决定簇2),只有12kDa左右,是已知的最小的抗原结合单位。这一特点使得其相对易于携带靶向药物进入细胞内部或穿越血脑屏障发挥作用。2)单域抗体具有更好的溶解度和稳定性。传统抗体VH的FR2区域通常会包含数个相对保守的疏水氨基酸,利于与VL通过疏水相互作用结合,但在VHH中这段区域常是暴露的,因此这几个氨基酸被演化替换成亲水性的氨基酸,例如,在传统抗体的VH中第37位的Val、第44位的Gly、第45位的Leu和第47位的Phe/Trp等疏水氨基酸,在骆驼科动物VHH中被相应替换为Phe/Tyr(aa37)、Glu/Gln(aa45)、Arg/Cys(aa45)、Gly/Arg/Leu/Ser(aa47)等相对亲水性更强的氨基酸[7-8]。这些氨基酸改变使得VHH在蛋白可逆折叠、热稳定性和抗蛋白降解等方面的性质相较于传统抗体更优。一些单域抗体可以耐受2.3–3.3mol/L的盐酸胍以及60–80℃的高温[9]。此外,VHH除形成Ig分子保守的FR1(Frameworkregion1,框架区域1)和FR3(Frameworkregion3,框架区域3)间的二硫键外,还可能形成连接CDR1(Complementarity-determiningregion1,互补决定簇1)和CDR3(Complementarity-determiningregion3,互补决定簇3)或者连接CDR2和CDR3之间的额外二硫键,从而进一步提高VHH构象结构的稳定性[10-12],这些二硫键甚至可以让单域抗体不被胃蛋白酶和糜蛋白酶降解,因此有些单域抗体可以口服应用[10]。3)单域抗体的CDR3较长,使其与抗原的结合方式更加灵活,此种结构特征使得单域抗体可以结合抗原凹状的隐藏表位,例如病毒的隐藏表位[13]和酶/受体蛋白分子的激活位点等[14-15]。4)与传统的鼠单克隆抗体相比,骆驼单域抗体的免疫原性更小,鼠源抗体与人源抗体的差异较大,导致其免疫原性强,一般需要经过复杂的人源化才能得到进一步的应用,而骆驼抗体的VH和人抗体的VH相似度很高,易于进行人源化改造和临床应用。
2单域抗体筛选方法
2.1基于噬菌体表面展示技术的单域抗体筛选
噬菌体表面展示技术最早由Smith等在1985年发展出来,该技术的核心是将目的基因通过基因工程方法融合表达在噬菌体外壳蛋白基因中,使其展示在噬菌体表面,进而可通过特异性富集筛选获得携带有靶蛋白/多肽的噬菌体,再进行克隆化和序列测定,并最终获得靶蛋白/多肽的DNA编码序列。这一技术借助噬菌体的高扩增性,将基因型和功能表型(结合活性)结合在一起,是一种非常高效的筛选系统[16]。
由于不存在传统抗体的轻重链匹配问题,单域抗体更适合采用噬菌体展示文库技术进行筛选。噬菌体单域抗体文库一般分为三大类:免疫库、天然库和全合成库。免疫库是指从预先免疫过的动物(如羊驼等)体内通过特异性富集靶抗原特异的B细胞基因,并扩增获得重链抗体VH基因而构建的单域抗体表达文库,通常只需较小库容即可筛选到高亲和力抗体。免疫库的受限因素在于免疫原的特征,不同免疫原在动物中的体液免疫应答强弱和表位差异均可能影响最终获得抗体的质量和多样性,最终筛选到的抗体同质化(如识别的表位相同等)程度较高。天然库是采用未经靶抗原免疫动物的B细胞扩增全部重链抗体VH基因构建的单域抗体文库。从天然库中筛选获得高亲和力单域抗体的成功率基本与库容成正比,理论上只要所构建的抗体库库容和多样性足够大(>109CFU/mL),即可从中筛选到针对各种靶抗原的高亲和力单域抗体,甚至是针对哺乳动物中高度保守的抗原(类似自身抗原)的单域抗体。尽管天然库已具有较高多样性,但由于在实际建库操作中,会因抗体基因家族的偏向性以及先天免疫耐受导致的克隆缺失等原因导致克隆多样性的降低。直接采用基因合成方法构建的合成单域抗体库可通过调节抗体分子中抗原结合区域附近的骨架区域来进一步提高库的多样性,也可直接基于人源化的VHH分子骨架进行合成构建。Moutel等新近采用全合成的方法构建了人源化的通用单域抗体库NaLi-H1,库容达到3×109CFU/mL,并从中成功筛选到若干针对不同靶标的高亲和力单域抗体(亲和力达到10–9CFU/mL–10–10mol/L)[17]。
噬菌体展示技术筛选抗体的流程一般包括以下几点(图2):1)抗体基因片段的获取。取羊驼或鲨鱼的外周血,采用淋巴细胞分离液分离得到淋巴细胞,提取淋巴细胞的总RNA,通过RT-PCR逆转录成cDNA,采用巢式PCR两步法扩增VHH基因,最后将VHH基因克隆到噬菌体载体上,克隆构建完成后可用二代测序的方法来质控文库质量。2)目的基因的淘选。先将噬菌体文库与不带有目的抗原的封闭液共孵育,进行负选,减少非特异性反应,提高抗体淘选的效率。再将抗原固定到固相载体上(聚苯乙烯板或者磁珠)进行淘选。淘选一般要进行多轮,每轮淘选后可采用Phage-ELISA检测,直到能检测到明显的富集效果。3)抗体的表达纯化。将目的抗体基因序列克隆到表达载体上,可以通过原核表达系统或真核表达系统进行表达。
2.2基于酵母表面展示技术的单域抗体筛选
酵母属于真核的单细胞生物,用于抗体展示技术的酵母一般是酿酒酵母Saccharomycescerevisiae,这种酵母有大约200nm厚的细胞壁,出芽的酵母细胞壁表面有凝集素蛋白,可以与相对交配型的酵母上的Aga2p蛋白结合,单域抗体便是以融合蛋白的形式与Aga2p蛋白融合表达并展示于酵母细胞表面[18-20]。
酵母展示抗体库的筛选方法一般采用磁珠辅助的细胞分选(MACS)和流式细胞分选(FACS),MACS的主要作用是为了减少非特异性结合,通常会在MACS筛选过后的基础上进行多轮的FACS筛选[20-21]。
相比于噬菌体展示技术,酵母展示技术既有优势也有不足。一方面酵母属于真核细胞,抗体的翻译后修饰与哺乳动物细胞类似,糖基化后的抗体稳定性高,同时也避免在哺乳动物表达系统中可能存在的未知情况。其次酵母展示技术采用的是流式细胞分选的方法,整个筛选过程的可控性更高[16]。但另一方面酵母抗体库的库容一般比噬菌体抗体库的小,最高到1×109CFU,但随着技术的优化,已有报道酵母抗体库的库容可以提高到1010CFU水平[22],而噬菌体抗体库的库容可以高达1011CFU。同时酵母展示技术在筛选低聚物的抗原时效果可能不理想,因为每一个酵母细胞上会同时展示1×104到1×105个抗体片段[20],因此一个酵母细胞可能同时共价结合多个抗原,这样便会导致筛选到的抗体的亲和力可能不如预期。
2.3基于细菌展示技术的单域抗体筛选
大肠埃希氏菌Escherichiacoli除了用于噬菌体文库的构建外,其本身也可以作为抗体展示的载体。E.coli属于革兰氏阴性菌,除了有细菌内膜,在细胞壁外还有一层细菌外膜。抗体片段通常展示在E.coli细菌的内膜,通过抗体的Fc段与膜上的脂蛋白结合,这种展示和表达方式称为锚定周质表达(Anchoredperiplasmicexpression,APEx)。但由于E.coli细菌细胞壁和外膜的存在,因此细菌需要通透处理成原生质球的形式才能与抗原结合[23-24]。利用外膜展示抗体的技术也被报道过,例如Salema等将抗体片段展示在自转运蛋白(EhaAautotransporter)或紧密黏附素(Intimin)上,这两种蛋白来源于E.coliO157:H7(EHEC)细菌的外膜,且可以在E.coliK-12细菌中表达和展示[25-27]。革兰氏阳性菌中的肉葡萄球菌Staphylococcuscarnosus也可以用于抗体展示,该方法是通过肉葡萄球菌的蛋白A上的细胞壁锚定区域(Cell-wallanchoringdomain)将抗体片段从细胞膜内转运到膜外并锚定在细胞壁上[28]。细菌展示技术的筛选方法一般采用流式细胞分选(FACS)的方式,同时也会结合磁珠辅助的细胞分选(MACS)。
推荐阅读:国内好投的医学核心期刊
论文发表期刊经常有从事医疗工作的网友,来咨询我们的老师,想知道国内好投的医学核心期刊有哪些。小编在这里给大家介绍下:目前,常用的国内核心期刊有:统计源核心、北大核心和南大核心。要说这几类核心期刊中,比较好投的就是统计源核心和北大核心了。若想知道具体哪些核心期刊好投,可以咨询在线编辑。
3单域抗体的应用
3.1单域抗体在显微镜学中的应用
因为单域抗体体积小,已经有许多研究证实了将单域抗体带上标签后,可以用作纳米级的检测工具。例如,针对GFP和RFP等荧光蛋白的单域抗体在标记上有机染料后可用于超分辨率显微镜成像[29-30]。2012年,Ries等利用该方法对稳定表达tubulin-YFP的Ptk2细胞进行成像,并最终将分辨率提高到(26.9±3.7)nm(细胞微管蛋白的直径为25nm)[29],而如果用传统的抗体,分辨率只能达到45nm左右。Chamma等将GFP的单域抗体应用于活细胞成像和双色荧光成像系统。他们利用单域抗体去活体标记轴突蛋白-1β,然后用双色成像系统去观察神经细胞间的跨突触连接[31]。GFP和RFP的单域抗体还可以用于研究亚细胞上的超微结构,例如核孔复合物和胞膜窖,与间接的抗体免疫化学方法不同,利用单域抗体染色可以更好地模拟这些超微结构的真实情况[32-33]。
3.2单域抗体用于结构生物学研究
单域抗体结合抗原可以稳定抗原的结构,并且单域抗体本身分子量小,对抗原的影响小,所以单域抗体被用于稳定一些结构不稳定的蛋白,辅助解析蛋白的结构。G蛋白偶联受体GPCRs(Gproteincoupledreceptors)是一大类膜蛋白受体的简称,是最著名的药物靶标分子。它参与了很多细胞信号转导的过程,可以调节人体许多生理学机能。相同的GPCRs可以结合不同亲和力的激动剂分子,并激活不同的下游信号通路。为了更好地理解不同的激动剂分子为何可以激活相同的受体,GPCRs的晶体结构解析是非常重要的手段。β2肾上腺素受体(β2-adrenoceptor,β2AR)是GPCRs的成员,它可以被许多天然激动剂,如肾上腺素(Adrenaline)等低亲和力地结合并激活,但不稳定。β2AR也可以和BI-167107(BoehringerIngelheim)等商品化激动剂高亲和力地结合并维持稳定的激活状态。G蛋白可以通过与β2AR结合并增强其与激动剂之间的亲和力。Nb80是一株来源于美洲驼(Llama)的单域抗体,它可以与β2AR结合并表现出和G蛋白一样的性质[34-35]。Rasmussen等利用Nb80与β2AR的变体β2AR-T4L(第3个胞内环被替换成T4溶菌酶)结合形成的复合物β2AR-T4L-Nb80成功地解析了BI-167107激活下的β2AR晶体结构,分辨率为3.5Å[34]。之后,Ring等通过酵母展示技术筛选不同的Nb80变体,并成功得到了一株Nb6B9抗体,这株抗体可以将BI-167107激活下的β2AR晶体结构分辨率提高到2.8Å,同时也解析了羟苄基异丙肾上腺素(hydroxybenzylisoproterenol,HBI)和adrenaline这两类低亲和力激动剂结合下的β2AR的晶体结构,分辨率分别为3.1Å和3.2Å[36]。Staus等还发现了一株可以显著降低β2AR与激动剂亲和力的抗体Nb60,进一步扩大了β2AR的变构潜力[37]。


